题目内容
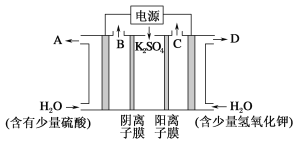
【题目】如图所示,组成原电池,回答下列问题。
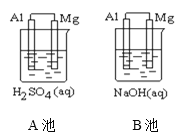
(1)该装置是把___________ 能转化为_________能的装置。
(2)A池中Mg电极是__________(填“正”或“负”)极,其在反应中_____(填“得到”或“失去”)电子,该极发生的反应是__________(填“氧化”或“还原”)反应,其电极反应为________________________,该装置中电流的方向是由_____到 ______。
(3)B池中负极材料是_________,该装置中电子的移动方向是由_____到 ______。
【答案】化学 电 负 失去 氧化 Mg—2e—=Mg2+ Al Mg Al Al Mg
【解析】
(1)原电池把化学能转化为电能;
(2)原电池中活泼金属做负极,负极失电子发生氧化反应;原电池中电流由正极经导线流向负极;
(3)B池中铝与氢氧化钠溶液反应,铝失电子发生氧化反应,铝是负极、镁是正极。原电池中电子由负极经导线流向正极。
(1)该装置为原电池是把化学能转化为电能的装置;
(2)镁的活泼性大于铝,A池中Mg电极是负极,Mg在反应中失去电子,发生氧化反应,其电极反应为Mg—2e—=Mg2+,原电池中电流由正极经导线流向负极,该装置中电流的方向是由Al到 Mg。
(3)B池中铝与氢氧化钠溶液反应,铝失电子发生氧化反应,Al是负极、Mg是正极。原电池中电子由负极经导线流向正极,电子的移动方向是由Al到 Mg。

【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一元素。
B | C | D | |||||
A | E | F | |||||
(1)A的的最高价氧化物对应水化物的电子式为__________。
(2)R是由表中已标出的A~F 中某三种元素组成的化合物,是常见家用消毒剂的主要成分,其化学名称为_____________;Na2FeO4是工业常用的消毒剂,利用R 制备Na2FeO4的原理如下,请补齐缺少的物质,并配平反应方程式的系数:___ Fe(OH)3 + ___R(________) + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
(3)气态氢化物沸点:D _____ E;元素形成的简单离子的半径:A _____ D(填“>”,“<”或“=”)
(4)E 的某种氧化物通入F 单质的水溶液中,并不能增大F 单质水溶液的漂白性,请结合方程式说明______________________________________________________________。
(5)由表中未标出的某种金属元素的单质G ,可以发生如图所示的转化:
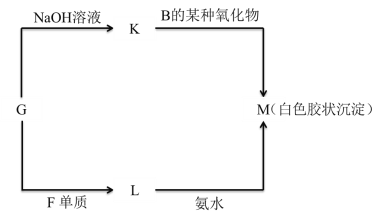
①写出 G 转化为 K 的化学方程式________________________________________。
②写出 L 转化为 M 的离子方程式________________________________________。