题目内容
【题目】工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿。软锰矿主要含有MnO2(约70%)、SiO2、Al2O3,闪锌矿主要含有ZnS(约80%)、FeS、CuS、SiO2。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14.5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0.1000mol·L﹣1的标准Na2S2O3溶液滴定,消耗标准液50.00ml,则软锰矿中MnO2含量____。(已知:2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32﹣=2I﹣+S4O62﹣)
Ⅱ.研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图所示。请回答下列问题:
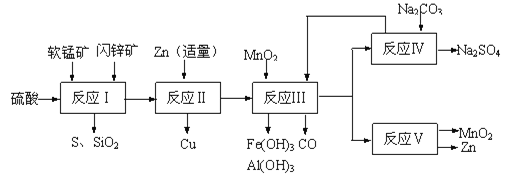
(2)反应Ⅰ后过滤所得滤液中含有有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金属阳离子。试写出反应Ⅰ中生成CuSO4的化学方程式____________。
(3)若反成Ⅱ加入的锌过量,还会进一步发生反应的离子方程式为_________。
(4)反应Ⅲ中加入MnO2的作用是(离子方程式表示)______________________。
(5)反应Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为__________。
(6)图是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→___→用乙醇洗涤→干燥.用乙醇洗涤而不用水洗的原因是___________。

【答案】60% MnO2 + CuS+ 2H2SO4 = S↓+ MnSO4+ CuSO4+ 2H2O Zn+Fe2+=Zn2++Fe 或 Zn+Mn2+=Zn2++Mn 4H++MnO2+2Fe2+=Mn2++2Fe3++2H2O Mn2+-2e-+2H2O=MnO2+4H+ 趁热过滤 防止Na2SO4固体因溶解而减少;避免形成结晶水合物
【解析】
(1)2KI+2H2SO4+MnO2=I2+2H2O+MnSO4+K2SO4;I2+2S2O32﹣=2I﹣+S4O62﹣,
MnO2~I2~2S2O32-,
1 2
n 0.1000molL-1×0.050L
n=0.0025mol,1L溶液中含MnO2物质的量=0.0025mol×![]() =0.1mol,则软锰矿中MnO2含量=
=0.1mol,则软锰矿中MnO2含量=![]() ×100%=60%;
×100%=60%;
(2)依据流程图分析判断,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,软锰矿和闪锌矿中的MnO2,CuS在酸性溶液中发生的氧化还原反应生成生成CuSO4、MnSO4和硫单质,反应的化学方程式为:MnO2+CuS+2H2SO4=S+CuSO4+MnSO4+2H2O;
(3)流程分析,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,加入锌反应生成铜,锌的主要作用是与铁离子反应生成亚铁离子、把铜离子转化为铜除去;锌过量会继续反应置换出铁(或锰);反应的离子方程式为:Zn+Fe2+=Fe+Zn2+(或Zn+Mn2+=Mn+Zn2+);
(4)反应Ⅲ中加入MnO2的作用是将Fe2+氧化为Fe3+,发生的反应离子方程式为4H++MnO2+2Fe2+=Mn2++2Fe3++2H2O;
(5)反应Ⅴ的条件是电解,电解时均用惰性电极,二氧化锰是在阳极锰离子失电子生成,故阳极发生的电极反应可表示为:Mn2+-2e-+2H2O=MnO2+4H+;
(6)图象分析可知温度较高时析出硫酸钠且浓度越高其溶解度越小,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤;洗涤晶体时用乙醇洗涤避免形成结晶水合物,故答案为:趁热过滤,防止Na2SO4固体因溶解而减少;避免形成结晶水合物Na2SO410H2O晶体。