题目内容
6.现用固体KOH配制0.1mol/L 的KOH溶液 480mL,回答下列问题:(1)配制过程中需要用到的玻璃仪器有烧杯.玻璃棒.量筒.胶头滴管.500mL容量瓶
(2)需要用托盘天平称量2.8gKOH固体.
(3)如果在定容时仰视操作,则所配得溶液的浓度<0.1mol/L(填>,=,<)
(4)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度>0.1mol/L (填>,=,<)
分析 (1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)由于实验室无450mL容量瓶,故应选择500mL的容量瓶,故配制出500mL溶液.根据所需的氢氧化钾的质量m=CVM来计算;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)氢氧化钠的摩尔质量小于氢氧化钾.
解答 解:(1)由于实验室无450mL容量瓶,故应选择500mL的容量瓶,根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器为烧杯、玻璃棒、托盘天平、500mL容量瓶和胶头滴管,故答案为:500mL容量瓶;
(2)由于实验室无450mL容量瓶,故应选择500mL的容量瓶,故配制出500mL溶液.所需的氢氧化钾的质量m=CVM=0.1mol/L×0.5L×56g/mol=2.8g,
故答案为:2.8;
(3)定容时仰视,则溶液体积偏大,故浓度小于0.1mol/L,故答案为:<;
(4)由于氢氧化钠的摩尔质量小于氢氧化钾,故所称量的固体的物质的量偏大,则所配得溶液的c(OH-)浓度大于0.1mol/L,故答案为:>.
点评 本题考查了一定物质的量浓度溶液的配制,难度不大,注意计算的方法.

练习册系列答案
相关题目
17.下列有关实验的叙述正确的是( )
| A. | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝,则原溶液中无NH4+ | |
| B. | 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| C. | 光照氯水有气泡冒出,该气体为Cl2 | |
| D. | 用四氯化碳萃取溴水中的溴后,分液时,有机层应从分液漏斗的上口倒出 |
14.下列叙述不正确的是( )
| A. | 常温常压下,3.2gO2所含的原子数为0.2NA | |
| B. | 标准状况下,18gH2O所含的氧原子数目为NA | |
| C. | 常温常压下,92gNO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA |
1.小明家里收藏了一件清代的铝制佛像,该佛像至今仍保存十分完好.该佛像未锈蚀的主要原因是( )
| A. | 铝易氧化,但氧化铝具有保护内部铝的作用 | |
| B. | 铝的氧化物容易发生还原反应 | |
| C. | 铝不易被氧化 | |
| D. | 铝不易发生化学反应 |
11.将等浓度的一元酸HA溶液与NaOH溶液等体积混合,不能证明HA是弱电解质的方法是( )
| A. | 测得0.1mol/L HA的pH>l | |
| B. | 测得NaA溶液的pH>7 | |
| C. | pH=l的HA溶液与盐酸稀释100倍后,盐酸的pH变化大 | |
| D. | 足量锌与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多 |
18.某工业生产的废液中含有FeCl2、FeCl3、AlCl3、MnCl2,欲从中提取MnCl2,方案如下:加H2O2溶液氧化;调节pH,产生沉淀X;过滤,得MnCl2溶液.已知各金属离子沉淀的pH范围如下:
(1)加入H2O2的目的是将亚铁离子氧化为铁离子;调节pH的范围是4.7~7.8;
(2)向沉淀X中加入NaOH溶液,有关反应的化学方程式为NaOH+Al(OH)3=NaAlO2+2H2O,过滤后将所得沉淀加热后得红棕色固体,写出高温下该固体与金属铝的反应方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)一定条件下电解含Mn2+的溶液可以制得MnO2,生成MnO2的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,同时在另一极还能获得一种清洁能源是H2.
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 |
(2)向沉淀X中加入NaOH溶液,有关反应的化学方程式为NaOH+Al(OH)3=NaAlO2+2H2O,过滤后将所得沉淀加热后得红棕色固体,写出高温下该固体与金属铝的反应方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)一定条件下电解含Mn2+的溶液可以制得MnO2,生成MnO2的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,同时在另一极还能获得一种清洁能源是H2.
14.下列物质的化学式书写正确是( )
| A. | 氯化钠( ClNa ) | B. | 高锰酸钾(K2MnO4) | C. | 硫酸钠(Na2S) | D. | 碳酸(H2CO3) |
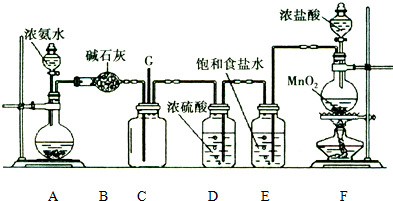


 .
. .
. (或
(或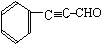 ).
). 、
、 、
、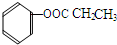 、
、 、
、 、
、 (写结构简式).
(写结构简式).