��Ŀ����
����Ŀ��ij�����Ĺ�ҵ��ˮ�к��д�����![]() ���϶��
���϶��![]() ������
������![]() Ϊ�˼�����Ⱦ�����Ϊ���������ƻ��Ӹ÷�ˮ�л������������ͽ���ͭ
Ϊ�˼�����Ⱦ�����Ϊ���������ƻ��Ӹ÷�ˮ�л������������ͽ���ͭ![]() �������������ͼ����ɻ�������������ͭ��ʵ�鷽��
�������������ͼ����ɻ�������������ͭ��ʵ�鷽��![]() �ɹ�ѡ����Լ�Ϊ���ۡ�ϡ
�ɹ�ѡ����Լ�Ϊ���ۡ�ϡ![]() ��NaOH��Һ���Լ�
��NaOH��Һ���Լ�![]()
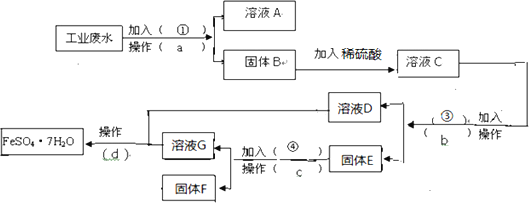
��1������a������Ϊ ______ ������Ҫ�IJ�������Ϊ ______ ��
��2������E�ijɷ�Ϊ ______ ��������Լ�![]() Ϊ ______ �������Ļ�ѧ����ʽΪ ______ ��
Ϊ ______ �������Ļ�ѧ����ʽΪ ______ ��
��3�������Լ�![]() ��Ŀ���� ______ ��
��Ŀ���� ______ ��
��4������ҺD����ҺG�еõ�![]() ����IJ���Ϊ ______ ����ȴ�ᾧ�� ______ ��ϴ�ӡ����
����IJ���Ϊ ______ ����ȴ�ᾧ�� ______ ��ϴ�ӡ����
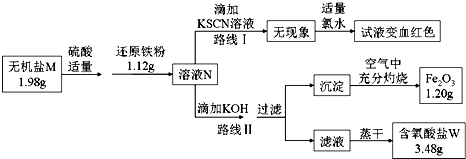
���𰸡� ���� ©�������������ձ� Fe��Cu ϡ���� ![]() ����Һ�е�
����Һ�е�![]() ��
��![]() ת��Ϊ�����������뺬��
ת��Ϊ�����������뺬��![]() ����Һ���� ����Ũ�� ����
����Һ���� ����Ũ�� ����
���������ȼӹ�������˵õ�Cu(OH)2��Fe(OH)2��������Һ��Na2SO4��NaOH��Һ����Cu(OH)2��Fe(OH)2�мӹ���ϡH2SO4����ҺC�ijɷ�ΪCuSO4��FeSO4��H2SO4������Һ�мӹ����������˳�Fe��Cu����ҺD��FeSO4���ڹ���E�мӹ���ϡH2SO4�����˳�Cu��ʵ���˻��ս���ͭ����Һ��FeSO4��H2SO4�������Һ��һ�飬����������Ũ������ȴ�ᾧ�����ˣ��͵õ�FeSO47H2O����������������
(1)����aΪ���ˣ����ڷ�������Һ�壬�õ��IJ���������©�������������ձ����ʴ�Ϊ�����ˣ�©�������������ձ���
(2)����EΪFe��Cu���������ᣬ�������ᷴӦ����������������Ӧ�Ļ�ѧ����ʽΪFe+H2SO4=FeSO4+H2�����ʴ�Ϊ��Fe��Cu��ϡ���Fe+H2SO4=FeSO4+H2����
(3)�Լ���ӦΪ�������ƣ��ɽ���Һ�е�Fe2+��Cu2+ת��Ϊ�����������뺬��Na+����Һ���룬�ʴ�Ϊ������Һ�е�Fe2+��Cu2+ת��Ϊ�����������뺬��Na+����Һ���룻
(4)����ҺD����ҺG�еõ�FeSO4��7H2O����IJ���Ϊ ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ʴ�Ϊ������Ũ�������ˡ�