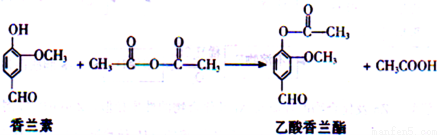
题目内容
高温下用H2还原CuCl制备活性铜,反应原理如下:
2Cu(s)+Cl2 (g) 2CuCl(s) △H1=-36 kJ·mol-1 ①
2CuCl(s) △H1=-36 kJ·mol-1 ①
H2(g)+2CuCl( s)=2Cu(s)+2HCl(g) △H2 ②
有关物质的键能数据如下表:
物质 | H2 | Cl2 | HCl |
键能(kJ·mol-1) | 436 | 243 | 432 |
(1)求△H2=_______ kJ·mol-1。
(2)经测定反应②制备活性铜的反应趋势大,原因是_______________。
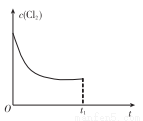
(3)在某温度下,反应①达到平衡状态,在tl时,增加压强到原来的2倍(Cu的量足够),在图中画出Cl2浓度的变化趋势线。_______________
(4)白色不溶于水的CuCl可以由电解法制得,如图所示:
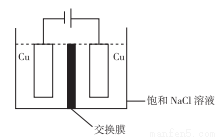
①装置中用的交换膜为_____________。
A.阳离子交换膜 B.阴离子交换膜 C.质子交换膜 D.氢氧根离子交换膜
②阳极的电极反应式为_________________。
(5)已知CuCl可溶解于稀硝酸,写出该反应的化学方程式:_________________。
(6)根据已学知识写出制取CuCl的一种方法,用化学方程式表示:_________________。
练习册系列答案
相关题目