题目内容
【题目】(1)已知2NO2(红棕色)![]() N2O4(无色)可以同时相互转化,①在密封有NO2的玻璃瓶中,升高温度,颜色加深,问NO2转化为N2O4是一个__________(填“吸热”或“放热”)反应;②在一个恒温恒压容器中,通入稀有气体。颜色_______(填“变深”、“变浅”或“不变”),平衡________移动(填“正向”、“逆向”或“不”下同);③在一个密闭恒容体系中,增大NO2的量,会引起NO2转化率________(填“增大”、“减小”或“不变”),颜色_______,再通入稀有气体增大压强,平衡________移动,颜色_________。
N2O4(无色)可以同时相互转化,①在密封有NO2的玻璃瓶中,升高温度,颜色加深,问NO2转化为N2O4是一个__________(填“吸热”或“放热”)反应;②在一个恒温恒压容器中,通入稀有气体。颜色_______(填“变深”、“变浅”或“不变”),平衡________移动(填“正向”、“逆向”或“不”下同);③在一个密闭恒容体系中,增大NO2的量,会引起NO2转化率________(填“增大”、“减小”或“不变”),颜色_______,再通入稀有气体增大压强,平衡________移动,颜色_________。
(2)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
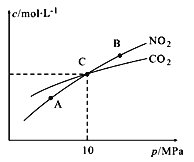
①A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②A、B、C三点中NO2的转化率最高的是_____(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】 放热 变浅 逆向 增大 变深 不 不变 = A 2
【解析】(1)①在密封有NO2的玻璃瓶中,升高温度,颜色加深,这说明平衡向逆反应方向进行,所以NO2转化为N2O4是一个放热反应;②在一个恒温恒压容器中,通入稀有气体,容器的容积一定增大,气体的浓度减小,所以颜色变浅,正反应体积减小,则平衡逆向移动;③在一个密闭恒容体系中,增大NO2的量,浓度增大,平衡向正反应方向进行,NO2转化率增大,但平衡后二氧化氮浓度仍然比原来大,因此颜色变深,再通入稀有气体增大压强,由于浓度不变,所以平衡不移动,颜色不变。
(2)①A、B两点温度相等,所以化学平衡常数相等;②由方程式可知正反应气体体积减小,增大压强,平衡逆向移动,NO2的转化率降低,A、B、C中A点压强最小,所以转化率最高;③设生成二氧化碳2x mol,则根据方程式可知:
2NO2(g)+2C(s)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol)1 0 0
转化量(mol)2x x 2x
平衡量(mol)1-2x x 2x
C点时NO2和CO2浓度相等,则1-2x=2x,解得:x=0.25,由于C点时NO2和CO2浓度相等,则NO2和CO2的分压也相等,即Kp(NO2)=Kp(CO2),Kp(C)=Kp2(CO2)Kp(N2)/Kp2(NO2)=Kp(N2)=10MPa×0.25/(0.5+0.25+0.5)=2MPa。

【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应逆反应的△H_____0(填“<”“>”“=”)。
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1。则6s时c(A)=_____________,C的物质的量为_____________;若反应经一段时间后,达到平衡时A的转化率为_______________,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为 ___________________。
(3)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为____________。
A(g)+B(g)的平衡常数的值为____________。