题目内容
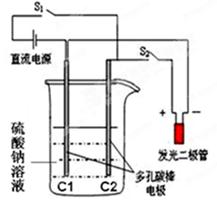
用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
| A.1 mol·L-1 | B.2 mol·L-1 | C.3 mol·L-1 | D.4 mol·L-1 |
A
试题分析:用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,阳极是氢氧根离子放电生成氧气,阴极先是铜离子放电生成铜,然后是氢离子放电生成氢气,而生成2.24L的氢气时对应阳极生成的氧气的体积是1.12L,所以与铜离子放电对应的氢氧根离子放电生成的氧气的体积是2.24L-1.12L=1.12L,物质的量是0.05mol,转移电子的物质的量是0.05mol×4=0.2mol,根据得失电子守恒规律,放电的铜离子的物质的量是0.1mol,所以原混合溶液中Cu2+的物质的量浓度为0.1mol/0.1L=1mol/L,答案选A。

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
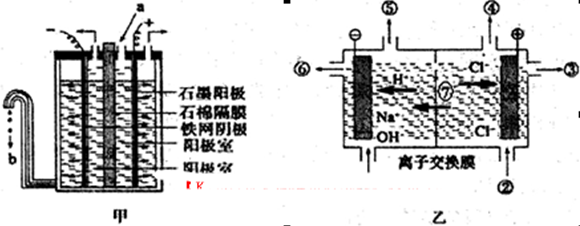

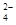 等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:
等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:
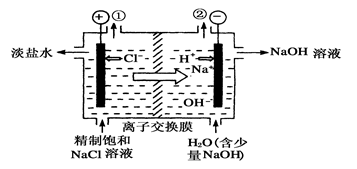
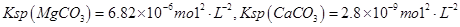 ,假设该粗盐水中
,假设该粗盐水中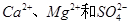 的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。