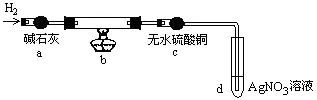
题目内容
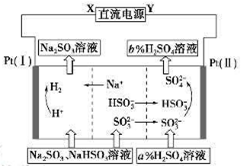
(14分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
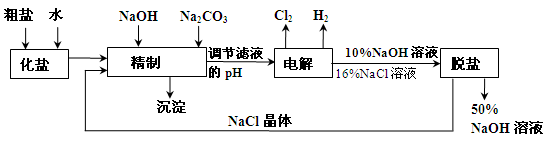
依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号)
a. Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
(6)写出电解饱和食盐水的离子方程式:

依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号)
a. Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
(6)写出电解饱和食盐水的离子方程式:
(14分)(每空2分)
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)由于BaSO4比BaCO3的溶解度小,SO42-促使BaCO3(s) Ba2+(aq)+ +CO32- (aq)
Ba2+(aq)+ +CO32- (aq)
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
(6)2Cl?+2H2O H2↑+Cl2↑+2OH?
H2↑+Cl2↑+2OH?
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)由于BaSO4比BaCO3的溶解度小,SO42-促使BaCO3(s)
 Ba2+(aq)+ +CO32- (aq)
Ba2+(aq)+ +CO32- (aq)平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
(6)2Cl?+2H2O
 H2↑+Cl2↑+2OH?
H2↑+Cl2↑+2OH?试题分析:(1)电解饱和食盐水的反应为:2NaCl+2H2O
 2NaOH+Cl2↑+H2↑与电源负极相连为阴极,生成氢气,电极反应式为2H++2e-=H2↑,氢气的电子式为H:H。
2NaOH+Cl2↑+H2↑与电源负极相连为阴极,生成氢气,电极反应式为2H++2e-=H2↑,氢气的电子式为H:H。(2)Mg2+和NaOH反应转化为沉淀,离子反应为:Mg2++2OH-═Mg(OH)2↓
(3)除杂的基本原则是除杂而不引杂,就是不能引入新的杂质.对于该混合物而言,氢氧根离子和氯离子都不是杂质,而硝酸根离子却是杂质,所以可以选用氢氧化钡,也可以选用氯化钡,但是不能选用硝酸钡,故答案为:ac。
(4)由于BaSO4比BaCO3的溶解度小,SO42-促使BaCO3(s)?Ba2+(aq)+CO32- (aq)平衡正向移动,生成更难溶的BaSO4沉淀。
(5)电解饱和食盐水的反应为:2NaCl+2H2O
 2NaOH+Cl2↑+H2↑,改写为离子方程式为:2Cl?+2H2O
2NaOH+Cl2↑+H2↑,改写为离子方程式为:2Cl?+2H2O H2↑+Cl2↑+2OH?。
H2↑+Cl2↑+2OH?。
练习册系列答案
相关题目

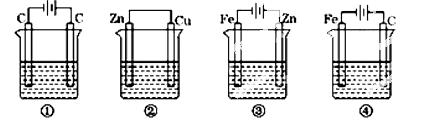
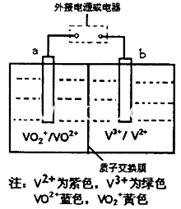
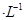 ,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是