题目内容
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品.
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应0~2min末的平均速率v(COCl2)= mol/(L·min).
②在2min~4min间,v(Cl2)正 v(Cl2)逆 (填“>”、“=”或“<”),该温度下K= .
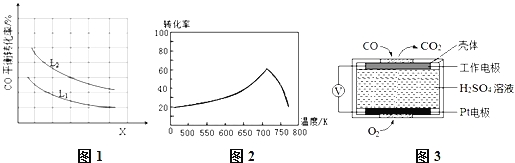
③已知X、L可分别代表温度或压强,图1表示L一定时,CO的转化率随X的变化关系.
X代表的物理量是 ;a 0 (填“>”,“=”,“<”).
(2)在催化剂作用下NO和CO转化为无毒气体,2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)△H=﹣748kJ·mol﹣1
2CO2(g)+N2(g)△H=﹣748kJ·mol﹣1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图2所示.温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是 .
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法.其中CO传感器的工作原理如图3所示,则工作电极的反应式为 ;方法2:氧化还原滴定法.用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度.写出NO与H2O2溶液反应的离子方程式 .
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g)![]() CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 .
CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 .
【答案】
(1)①0.1;②=;5;③温度;<;
(2)①温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低;②CO-2e-+H2O═CO2+2H+;2NO+3H2O2═2NO3-+2H2O+2H+;
(3)c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)。
【解析】
试题分析:(1)①由表中数据,可知0~2min内△n(CO)=1.2mol-0.8mol=0.4mol,由方程式可知△c(COCl2)=△c(CO)=0.4mol,则v(COCl2)=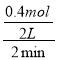 =0.1mol/(L.min),故答案为:0.1;
=0.1mol/(L.min),故答案为:0.1;
②4min内,反应的氯气为0.6mol-0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol-0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态,在2min~4min间,v(Cl2)正 =v(Cl2)逆,由方程式可知,平衡时生成COCl2为0.4mol,该温度下平衡常数K=![]() =
=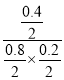 =5,故答案为:=;5;
=5,故答案为:=;5;
③正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应,故a<0,故答案为:温度;<;
(2)①当温度升高到710K时,单位时间内反应达平衡,由于该反应是放热反应,再升高温度,平衡向左移动,转化率降低,故答案为:温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低;
②该装置是原电池,通入一氧化碳的电极是负极,负极上一氧化碳失电子发生氧化反应,电极反应式为:CO-2e-+H2O═CO2+2H+,NO被H2O2溶液氧化成强酸硝酸,双氧水被还原成水,则反应的离子方程式2NO+3H2O2═2NO3-+2H2O+2H+,故答案为:CO-2e-+H2O═CO2+2H+;2NO+3H2O2═2NO3-+2H2O+2H+;
(3)当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,根据元素守恒可以计算n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,二者的水溶液均为碱性,所以c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+),故答案为:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)。
