题目内容
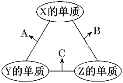
【题目】某工厂的工业废水中含有大量的硫酸亚铁、较多的Cu2+和较少的Na+以及部分泥沙.为了减少污染并变废为宝,工厂计划从该废水中回收绿矾和金属铜.请根据如图流程图完成实验方案.

(1)操作1的名称___________.所需的玻璃仪器有_____________________
(2)已知试剂1为Fe,试剂2为稀硫酸,则滤渣2所含物质的化学式为__________
(3)在澄清溶液中加入试剂1后发生化学反应,请写出该反应的离子方程式____________.
(4)滤渣1中加入试剂2后发生化学反应,请写出该反应的离子方程式________________。
【答案】 过滤 烧杯、玻璃棒、漏斗 Cu Fe+Cu2+=Fe2++Cu Fe+2H+=Fe2++H2↑
【解析】工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,试剂1为Fe,操作I为过滤,试剂2为稀硫酸,操作2为过滤,则滤液2中含硫酸亚铁,滤渣2为Cu,滤液1中含硫酸亚铁,然后蒸发、浓缩、结晶、过滤,可得到FeSO4·7H2O,据此解答。
(1)由上述分析可知,操作1为分离不溶性固体与液体,是过滤,在实验室完成该操作所需的玻璃仪器有烧杯、玻璃棒、漏斗;
(2)由上述分析可知,试剂1为Fe,发生Cu2++Fe=Fe2++Cu,试剂2为硫酸,铁粉、铜中加入适量稀硫酸,稀硫酸和铁粉反应生成硫酸亚铁,铜与稀硫酸不反应,则滤渣2所含物质的化学式为Cu;
(3)根据以上分析可知在澄清溶液中加入试剂1后发生化学反应,该反应的离子方程式为Cu2++Fe=Fe2++Cu;
(4)加入试剂2后发生化学反应,其反应的化学方程式为Fe+H2SO4=FeSO4+H2↑,离子方程式为Fe+2H+=Fe2++H2↑。

【题目】如表列出了①~⑧八种元素在周期表中的位置:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
二 | ① | |||||||
三 | ② | ③ | ④ | ⑤ | ⑦ | |||
四 | ⑥ | ⑧ |
请按要求回答下列问题:
(1)元素③的原子结构示意图是_________________________,以上元素的最高价氧化物形成的水化物酸性最强的是_______________________(填分子式)。
(2)②、③、⑦三种元素的原子形成的简单离子半径由大到小的顺序排列为_____________(用离子符号表示);②、③、⑥三种元索的最高价氧化物对应的水化物碱性由弱到强的顺序是__________________(用化学式表示)。
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为________________。
(4)用离子方程式证明⑦⑧两元素非金属性的强弱__________________。
【题目】A、B、C、D、E为短周期元素,在周期表中所处的位置如下图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
A | C | |
D | B | E |
(1)写出三种元素名称A________、B _______、C_______。
(2)B元素位于元素周期表中第______周期,_______族。
(3)比较B、D、E三种元素的最高价氧化物的水化物酸性最强的是(用化学式表示)______。
(4)C原子结构示意图为________________。
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃