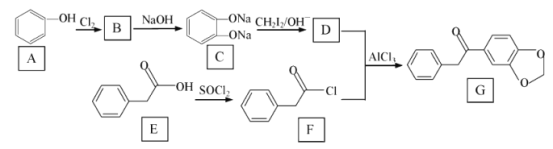
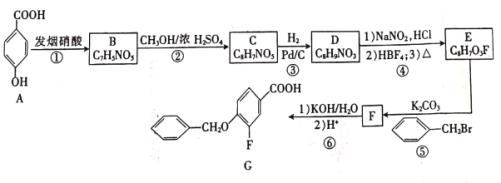
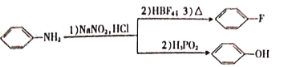
题目内容
【题目】钙钛矿太阳能电池具有转化效率高、低成本等优点,是未来太阳能电池的研究方向。回答下列问题:
(1)下列状态的钙中,电离最外层一个电子所需能量最大的是__________(填字母标号)。
A.[Ar]4s1 B.[Ar]4s2 C.[Ar]4s14p1 D.[Ar]4p1
(2)基态钛原子的核外价电子轨道表达式为____________。
(3)一种有机金属卤化钙钛矿中含有NH2-CH=NH2+,该离子中氮原子的杂化类型为___________,其对应分子NH2-CH=NH的熔沸点高于CH3CH2CH=CH2的熔沸点的原因为__________。
(4)一种无机钙钛矿CaxTiyOz的晶体结构如图所示,则这种钙钛矿化学式为___________,已知Ca和O离子之间的最短距离为a pm,设阿伏加德罗常数的值为NA,则这种钙钛矿的密度是___________g·cm-3(列出计算表达式)。
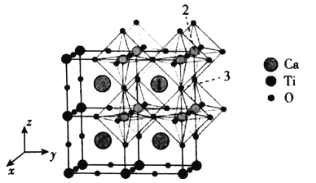
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(![]() ,
,![]() ,
,![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
【答案】A ![]() sp2和sp3 NH2—CH=NH分子间可形成氢键,熔沸点比CH3CH2CH=CH2高 CaTiO3
sp2和sp3 NH2—CH=NH分子间可形成氢键,熔沸点比CH3CH2CH=CH2高 CaTiO3 ![]() (0,1,1)
(0,1,1) ![]()
【解析】
(1)[Ar]4s1属于基态的Ca+,由于Ca的第二电离能高于其第一电离能,故其在失去一个电子所需能量较高,[Ar]4s2属于基态的Ca原子,其失去一个电子变为基态Ca+,[Ar]4s14p1属于激发态Ca原子,其失去以电子所需要的能量低于基态Ca原子,[Ar]4p2属于激发态的Ca+,其失去一个电子所需要的能量低于基态的Ca+,综上所述,电离最外层一个电子所需能量最大的是[Ar]4s1,A正确,故答案为:A;
(2)基态Ti原子的原子序数为22,其核外价电子排布式为3d24s2,轨道表达式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)NH2—CH=NH2+中左边的N有3对共用电子对,还有1对孤电子对,则价层电子对为4,杂化类型为sp3,右边的N与C形成双键杂化类型为sp2,NH2—CH=NH分子间可形成氢键,熔沸点比CH3CH2CH=CH2高,故答案为:sp2和sp3;NH2—CH=NH分子间可形成氢键,熔沸点比CH3CH2CH=CH2高;
(4)根据钙钛矿CaxTiyOz的晶体结构分析,Ca2+位于晶胞的体心,Ti4+位于晶胞的顶点,O2-位于以Ti4+为体心的正八面体的顶点,则一个晶胞中含有1个Ca2+,1个Ti4+和3个O2-,则化学式为CaTiO3,Ca2+和O2-之间的最短距离为a pm,则晶胞参数为![]() pm,一个晶胞相当于有一个CaTiO3,根据密度公式可得
pm,一个晶胞相当于有一个CaTiO3,根据密度公式可得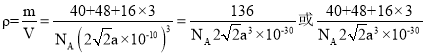 ,故答案为:CaTiO3;
,故答案为:CaTiO3;![]() ;
;
(6)根据坐标建立的方向,由原子1的坐标为![]() ,则原子2的坐标为(0,1,1),原子3的坐标为
,则原子2的坐标为(0,1,1),原子3的坐标为![]() ,故答案为:(0,1,1);
,故答案为:(0,1,1);![]() 。
。

【题目】现向下列装置中缓慢通入气体X,分别进行关闭和打开活塞K的操作,则品红溶液和澄清石灰水中现象相同的一组是
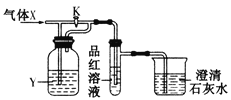
选项 | A | B | C | D |
X | NO2 | SO2 | Cl2 | CO2 |
Y(过量) | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D