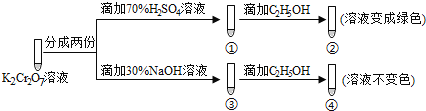
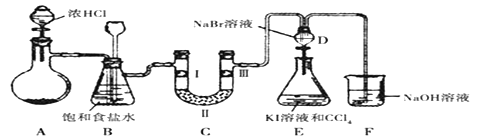
题目内容
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线画出。

根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为____________________
(2)铁元素位于元素周期表的__________区;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________。
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO互为等电子体的分子和离子分别为__________和__________(填化学式)。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有__________。
(5)根据VSEPR模型预测ED的空间构型为__________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为__________(写2种)。
【答案】(1)4s24p1(2)d 0 (3)N2CN-、NO+、C
(4)CH4、CH3OH (5)正四面体 CO2、NCl3、CCl4、CO
【解析】试题分析:(1)Ga位于第四周期第IIIA族,最外层有3个电子,其最外层电子排布式为4s24p1;
(2)元素周期表五区的划分是根据最后排入的电子名称命名的.Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,根据能量最低原理先排4s电子后排3d电子,所以 最后排入的是3d电子,根据命名规则属d区,根据化合物化合价的代数和为0,Fe与CO易形成配合物Fe(CO)5化合价的代数和为0,CO的化合价的代数和为0;
(3)根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等.对于原子,原子序数=原子核外电子总数,所以,如果是分子,只要原子序数之和相等即可.CO中C是6号元素,O是8号元素,原子序数之和为14,N是7号元素,且可形成双原子分子,所以分子是N2;
(4)在CH4中价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化.在CO分子中价层电子对数=σ键电子对数(1)+中心原子上的孤电子对数(1),所以碳原子采取sp杂化.CH3OH中,价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化;
(5)根据元素周期表知,E是Cl元素,D是O元素,ED4-是ClO4-离子,价层电子对数=σ键电子对数+中心原子上的孤电子对数,价层电子对数=4+(7+1-4×2)=4,根据VSEPR理论预测ED4-离子的空间构型为正四面体型;C、N、O、Cl是四种元素,两两形成的化合物且每个原子最外层都达到8电子稳定结构的化合物有:CO2CCl4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】[化学-选修3:物质结构与性质]
氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。
请回答下列问题:
(1)与氧同周期的相邻元素中,第一电离能由大到小的顺序为_______________。
(2)臭鼬排放的臭气主要成分为3-MBT(3-甲基-2-丁烯硫醇,结构如下图)。
![]()
1mol3-MBT中含有σ键数目为_______________(NA为阿伏伽德罗常数的值)。沸点:3-MBT____________(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是___________________。
(3)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是_____________(填选项字母)。
A.中心原子的价层电子对数目相等 |
B.都是极性分子 |
C.中心原子的孤对电子数目相等 |
D.都含有极性键 |
②SO3分子的空间构型为________,与其互为等电子体的阴离子为_____________(举一例)。将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______。

(4)元素X与硒同周期,X元素原子核外未成对电子数最多,X为________(填元素符号),X的基态原子的电子排布式为_______。
(5)单质钋是由_____键形成的晶体;若已知Po的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为_________g/cm3