题目内容
X、Y是周期表中前20号中的两种元素(非稀有气体元素),X原子的半径比Y的半径小,且具有相同的电子层数(m、n均为正整数),下列有关叙述正确的是( )
分析:X原子的半径比Y的半径小,且具有相同的电子层数,说明二者在周期表中同一周期,根据同周期从左到右原子半径逐渐减小,可知X的原子序数比Y的大,在周期表中Y的右侧,以此进行判断.
解答:解:X原子的半径比Y的半径小,且具有相同的电子层数,说明二者在周期表中同一周期,根据同周期从左到右原子半径逐渐减小,可知X的原子序数比Y的大,在周期表中Y的右侧,
A、如二者在第二周期,Y最高价为+5,则X可能为O或F元素,无正价,最高价为0,故A错误;
B、如X为N元素,则则X的氢化物溶液于水呈碱性,故B错误;
C、若Y元素形成的单质是气体,则Y可能是N或O,X可能为O或F元素,则X元素形成的单质一定是气体,故C正确;
D、如X为非金属元素,Y为金属元素,则X的离子比Y的离子多一个电子层,X离子的半径大,故D错误.
故选C.
A、如二者在第二周期,Y最高价为+5,则X可能为O或F元素,无正价,最高价为0,故A错误;
B、如X为N元素,则则X的氢化物溶液于水呈碱性,故B错误;
C、若Y元素形成的单质是气体,则Y可能是N或O,X可能为O或F元素,则X元素形成的单质一定是气体,故C正确;
D、如X为非金属元素,Y为金属元素,则X的离子比Y的离子多一个电子层,X离子的半径大,故D错误.
故选C.
点评:本题考查同周期元素单质及其化合物的性质,题目难度不大,把握同周期元素的性质递变规律是本题的关键.

练习册系列答案
相关题目
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如表:
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是 .
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示).
②M是含有 键的 分子(填“极性”或“非极性”)
③N是一种易液化的气体,请简述其易液化的原因 .
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 .
⑤AB-离子中和B2分子的π键数目比为 .
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E元素组成的单质的晶体堆积模型为 (填代号)
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②F元素在其化合物中最高化合价为 .
③G2+离子的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 .
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2754 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①A、B、C的第一电离能由小到大的顺序为
②M是含有
③N是一种易液化的气体,请简述其易液化的原因
④W分子的VSEPR模型的空间构型为
⑤AB-离子中和B2分子的π键数目比为
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E元素组成的单质的晶体堆积模型为
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②F元素在其化合物中最高化合价为
③G2+离子的核外电子排布式为
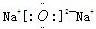
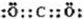
 (2013?辽宁一模)[化学--选修3物质结构与性质]
(2013?辽宁一模)[化学--选修3物质结构与性质]