题目内容
W、X、Y和Z都是周期表中前18号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y离子化合物;
②Y和Z属同族元素,它们能形成两种气态化合物;
③X和Y属同一周期元素,它们能形成组成为XY2共价化合物,一个XY2分子中的电子总数为22;
(1)W元素是
(2)化合物W2Y和XY2的电子式分别是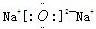
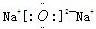 和
和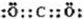
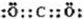 .
.
(3)Y和Z形成的两种气态化合物的分子式是
(4)写出化合物XY2与W的高价氧化物对应水化物反应的离子方程式:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y离子化合物;
②Y和Z属同族元素,它们能形成两种气态化合物;
③X和Y属同一周期元素,它们能形成组成为XY2共价化合物,一个XY2分子中的电子总数为22;
(1)W元素是
Na
Na
;Z元素是S
S
.(2)化合物W2Y和XY2的电子式分别是
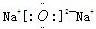
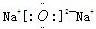
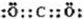
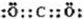
(3)Y和Z形成的两种气态化合物的分子式是
SO2
SO2
和SO3
SO3
.(4)写出化合物XY2与W的高价氧化物对应水化物反应的离子方程式:
CO2+2OH-═CO32--+H2O
CO2+2OH-═CO32--+H2O
.分析:W、X、Y和Z都是周期表中前18号元素,Y和Z属同族元素,它们能形成两种气态化合物,化合物为SO2、SO3,则Y、Z可能为O或S;若Y为O,由X和Y属同一周期元素,它们能形成组成为XY2共价化合物,一个XY2分子中的电子总数为22,X的质子数为22-8×2=6,则X为C;若Y为S,则X的质子数为22-16×2=-10,不符合事实,则Y为O,Z为S,X为C;W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y离子化合物,则W为Na,然后利用元素及其单质、化合物的性质来解答.
解答:解:W、X、Y和Z都是周期表中前18号元素,Y和Z属同族元素,它们能形成两种气态化合物,化合物为SO2、SO3,则Y、Z可能为O或S;若Y为O,由X和Y属同一周期元素,它们能形成组成为XY2共价化合物,一个XY2分子中的电子总数为22,X的质子数为22-8×2=6,则X为C;若Y为S,则X的质子数为22-16×2=-10,不符合事实,则Y为O,Z为S,X为C;W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y离子化合物,则W为Na,
(1)W为Na,Z为S,故答案为:Na;S;
(2)化合物W2Y为Na2O,为离子化合物,电子式为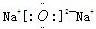 ,XY2为CO2,为共价化合物,电子式为
,XY2为CO2,为共价化合物,电子式为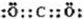 ,
,
故答案为: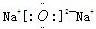 ;
;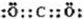 ;
;
(3)Y为O,Z为S,形成两种气态化合物为SO2、SO3,故答案为:SO2;SO3;
(4)W的高价氧化物对应水化物为NaOH,与CO2反应生成碳酸钠和水,离子反应为CO2+2OH-═CO32--+H2O,故答案为:CO2+2OH-═CO32--+H2O.
(1)W为Na,Z为S,故答案为:Na;S;
(2)化合物W2Y为Na2O,为离子化合物,电子式为
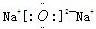 ,XY2为CO2,为共价化合物,电子式为
,XY2为CO2,为共价化合物,电子式为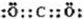 ,
,故答案为:
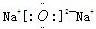 ;
;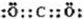 ;
;(3)Y为O,Z为S,形成两种气态化合物为SO2、SO3,故答案为:SO2;SO3;
(4)W的高价氧化物对应水化物为NaOH,与CO2反应生成碳酸钠和水,离子反应为CO2+2OH-═CO32--+H2O,故答案为:CO2+2OH-═CO32--+H2O.
点评:本题考查位置、结构、性质的应用,元素的推断是解答本题的关键,Y、Z的推断是解答本题的突破口,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:
(2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表: