题目内容
【化学--选修3物质结构与性质】
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍.请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
(l)W、Y、Z 三种元素的第一电离能由大到小的顺序为 .在上述三种元素的原子中,写出与WZ2互为等电子体的分子式 .
(2)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键)
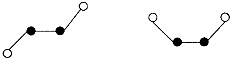
该分子中Y原子的杂化方式是 杂化.
(3)W2-2阴离子的电子式为 ,Z原子最外层电子排布式为 .
(4)YQ3分子的空间构型为 ,Y和Q两元素的氢化物的沸点相比较,高者是 (写分子式).往硫酸铜溶液中通入过量的YH3(Y的氢化物分子式),可生成配离子[Cu(YH3)4]2+,但YQ3不易与Cu2+形成配离子,其原因是 .
(5)科学家通过X射线探明RZ的晶体结构与NaCl晶体结构相似.那么在RZ晶体中距离R2+最近且等距离的R2+有 个.若在RZ晶体中阴阳离子间最近距离为a cm,晶体密度为ρg/cm3,则阿伏伽德罗常数NA的表达式为 mol-1.
(6)已知非整数比化合物R0.95Z,其晶体结构与NaCI相似,但由于R、Z离子个数比小于1:1,故晶体存在缺陷.R0.95Z可表示为
A、R
R
Z B、R
R
Z C、R
R
Z D、Fe2+0.85Fe3+0.1O.
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍.请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
(l)W、Y、Z 三种元素的第一电离能由大到小的顺序为
(2)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键)
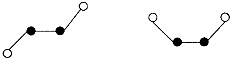
该分子中Y原子的杂化方式是
(3)W2-2阴离子的电子式为
(4)YQ3分子的空间构型为
(5)科学家通过X射线探明RZ的晶体结构与NaCl晶体结构相似.那么在RZ晶体中距离R2+最近且等距离的R2+有
(6)已知非整数比化合物R0.95Z,其晶体结构与NaCI相似,但由于R、Z离子个数比小于1:1,故晶体存在缺陷.R0.95Z可表示为
A、R
2+ 0.45 |
3+ 0.5 |
2+ 0.25 |
3+ 0.70 |
2+ 0.15 |
3+ 0.80 |
分析:W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.Q是电负性最大的元素,则Q为F元素;W原子核外有2个未成对电子,原子序数小于F且相差至少为3,处于第二周期,W核外电子排布为1s22s22p2,则W为C元素;结合原子序数可知,Y为N元素、Z为O元素;R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍,则R原子未成对电子数为4,则R处于第四周期,其原子核外电子排布为1s22s22p63s23p63d64s2,则R为Fe元素,据此解答.
解答:解:W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.Q是电负性最大的元素,则Q为F元素;W原子核外有2个未成对电子,原子序数小于F且相差至少为3,处于第二周期,W核外电子排布为1s22s22p2,则W为C元素;结合原子序数可知,Y为N元素、Z为O元素;R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍,则R原子未成对电子数为4,则R处于第四周期,其原子核外电子排布为1s22s22p63s23p63d64s2,则R为Fe元素,
(l)同周期自左而右元素第一电离能呈增大趋势,但N元素的2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;在上述三种元素的原子中,写出与CO2互为等电子体的分子式N2O,
故答案为:N>O>C;N2O;
(2)F原子成一个共价键,由模型可知:白色球表示F、黑色球表示N,N原子之间应成N=N双键,N2F2分子中N原子价层电子对数=2+
=3,N原子采取sp2杂化,
故答案为:sp2;
(3)C22-阴离子中C原子之间形成三对共用电子对,且都满足8电子稳定结构,其电子式为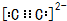 ,O原子最外层电子排布式为2s22p4,
,O原子最外层电子排布式为2s22p4,
故答案为: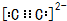 ;2s22p4;
;2s22p4;
(4)NF3分子中N原子价层电子对数=3+
=4,N原子含有1对孤对电子,故其空间构型为三角锥形;
Y和Q两元素的氢化物分别为NH3、HF,由于电负性F>N,故HF分子之间的氢键比NH3分子之间的氢键更强,且HF的范德华力更强,故HF的沸点更高;
由于电负性F>N>H,NF3分子中共用电子对偏向F原子,使得N原子上的孤对电子难与Cu2+形成配合物,
故答案为:三角锥形;HF;由于电负性F>N>H,NF3分子中共用电子对偏向F原子,使得N原子上的孤对电子难与Cu2+形成配合物;
(5)科学家通过X射线探明FeO的晶体结构与NaCl晶体结构相似.若以为Fe2+体心,在FeO晶体中距离Fe2+最近且等距离的Fe2+位于棱的中心上,故共有12个;FeO的晶体结构与NaCl的晶体结构相似,则一个晶胞中含有4个“FeO”,NA个“FeO”的质量为72g,FeO晶体中阴阳离子间最近距离为acm,则体积为(2a cm)3=8a3 cm3,晶胞质量为8a3 cm3×ρg/cm3=8ρa3g,所以
×4=8ρa3g,故NA=
,
故答案为:12;
;
(6)设1molFe0.95O中含有Fe3+有x mol,Fe2+有y mol,利用电荷守恒和原子守恒,则有
,
解之得:x=0.1,y=0.85,故Fe0.95O可表示为Fe2+0.85Fe3+0.1O,
故答案为:D.
(l)同周期自左而右元素第一电离能呈增大趋势,但N元素的2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;在上述三种元素的原子中,写出与CO2互为等电子体的分子式N2O,
故答案为:N>O>C;N2O;
(2)F原子成一个共价键,由模型可知:白色球表示F、黑色球表示N,N原子之间应成N=N双键,N2F2分子中N原子价层电子对数=2+
| 5-1-2 |
| 2 |
故答案为:sp2;
(3)C22-阴离子中C原子之间形成三对共用电子对,且都满足8电子稳定结构,其电子式为
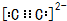 ,O原子最外层电子排布式为2s22p4,
,O原子最外层电子排布式为2s22p4,故答案为:
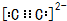 ;2s22p4;
;2s22p4;(4)NF3分子中N原子价层电子对数=3+
| 5-1×3 |
| 2 |
Y和Q两元素的氢化物分别为NH3、HF,由于电负性F>N,故HF分子之间的氢键比NH3分子之间的氢键更强,且HF的范德华力更强,故HF的沸点更高;
由于电负性F>N>H,NF3分子中共用电子对偏向F原子,使得N原子上的孤对电子难与Cu2+形成配合物,
故答案为:三角锥形;HF;由于电负性F>N>H,NF3分子中共用电子对偏向F原子,使得N原子上的孤对电子难与Cu2+形成配合物;
(5)科学家通过X射线探明FeO的晶体结构与NaCl晶体结构相似.若以为Fe2+体心,在FeO晶体中距离Fe2+最近且等距离的Fe2+位于棱的中心上,故共有12个;FeO的晶体结构与NaCl的晶体结构相似,则一个晶胞中含有4个“FeO”,NA个“FeO”的质量为72g,FeO晶体中阴阳离子间最近距离为acm,则体积为(2a cm)3=8a3 cm3,晶胞质量为8a3 cm3×ρg/cm3=8ρa3g,所以
| 72g |
| NA |
| 36 |
| ρa3 |
故答案为:12;
| 36 |
| ρa3 |
(6)设1molFe0.95O中含有Fe3+有x mol,Fe2+有y mol,利用电荷守恒和原子守恒,则有
|
解之得:x=0.1,y=0.85,故Fe0.95O可表示为Fe2+0.85Fe3+0.1O,
故答案为:D.
点评:本题考查物质结构与性质,涉及核外电子排布规律、电离能、分子结构、杂化轨道、配合物、氢键、晶胞结构与计算等,难度较大,(5)为易错点、难点,需要学生识记常见晶体的晶胞结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 【化学--选修3物质结构与性质】
【化学--选修3物质结构与性质】
 该配离子中含有的化学键类型有
该配离子中含有的化学键类型有

