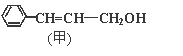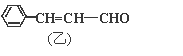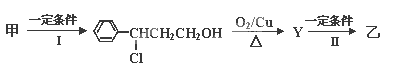题目内容
【题目】已知热化学方程式C2H2(g)+![]() O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,下列说法正确的是( )
O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1,下列说法正确的是( )
A.乙炔的燃烧热为-1256kJ·mol-1
B.若转移10mol电子,则消耗2.5molO2
C.若生成2mol液态水,则ΔH=-2512kJ·mol-1
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ
【答案】B
【解析】
A、燃烧热是指在25 ℃、101 kPa下,1 mol纯物质完全燃烧生成稳定的氧化物时放出的热量,已知热化学方程式中水是气体,不是稳定的氧化物,燃烧热应小于-1 256 kJ·mol-1,选项A错误;
B、1 mol氧气反应转移4 mol电子,消耗2.5 mol氧气,电子转移为10 mol,选项B正确;
C、气态水变为液态水放热,若生成2 mol液态水,则ΔH<-2 512 kJ·mol-1,C错误;
D、形成4 mol碳氧共用电子对,对应生成1 mol二氧化碳,放出的热量为628 kJ,D错误。
答案选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目