题目内容
下列条件下钢铁不易被腐蚀的是:
| A.电解食盐水铁做阴极 |
| B.酸雨 |
| C.镀锡铁镀层被破坏 |
| D.潮湿空气 |
A
解析试题分析:A、用电解原理保护金属时,金属应作电解池阴极,阴极上带负电荷,易发生还原反应,保铁不被腐蚀;B、酸雨呈酸性,铁、杂质和雨水能构成原电池,铁作原电池负极而容易被腐蚀,另外H+离子浓度高,加快腐蚀速率;C、铁的还原性强,Fe―2e―=Fe2+腐蚀更快;D、提供原电池反应的发生所需条件,加快腐蚀速率。选A。
考点 :金属防腐

练习册系列答案
相关题目
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为CH3CH2OH—2e—=X+H+。下列说法中正确的是
| A.电池内部H+由正极向负极移动 |
| B.另一极的电极反应式为O2+4e-+2H2O=4OH- |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池总反应式为2CH3CH2OH+O2=2CH3CHO+2H2O |
镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O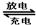 Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
| A.放电时,Cd作负极 |
| B.放电时,NiO(OH)作负极 |
| C.电解质溶液为碱性溶液 |
| D.放电时,负极反应为Cd+2OH--2e-=Cd(OH)2 |
铁皮表面镀锌是钢铁防锈的常用方法,电镀过程中正确的是
| A.电镀时铁皮连接电源正极 | B.电镀时锌块发生氧化反应 |
| C.电镀液中Zn2+浓度明显下降 | D.电镀液中电子由铁流向锌 |
下图为某化工厂用石墨电解Na2CrO4溶液制备Na2Cr2O7的模拟装置,下列有关说法错误的是( )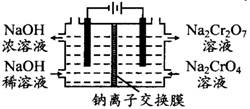
| A.溶液中OH-由阴极区流向阳极区 |
| B.阳极区产生的气体与阴极区产生的气体在相同状况 下体积之比为1:2 |
| C.阳极的电极反应式为:2H2O-4e-=O2↑+4H+ |
| D.Na2CrO4转化为Na2Cr2O7的离子方程式为:2CrO42-+2H+= Cr2O72-+H2O |
有关钢铁电化学腐蚀及保护的下列叙述中正确的是
| A.钢铁的电化学腐蚀过程可用原电池或电解池的原理来解释 |
| B.可将河道中的钢铁闸门与外加直流电源的负极相连以保护其不受腐蚀 |
| C.在钢铁表面镀锌属于牺牲阳极阴极保护法 |
| D.钢铁的电化学腐蚀中,主要是吸氧腐蚀 |
某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流计A指针偏转。下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:2Cl-+2H+  H2↑+Cl2↑ H2↑+Cl2↑ |
| B.断开K2,闭合K1时,a是电源的正极,铁电极发生氧化反应 |
| C.断开K1,闭合K2时,石墨电极附近溶液变红,铁电极上的电极反应为:Cl2+2e→2Cl- |
| D.断开K1,闭合K2时,石墨电极作正极 |
用气体传感器可以检测汽车尾气中CO的含量。传感器是以燃料电池为工作原理,其装置如右图所示,该电池中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是
A.负极的电极反应式为:CO+O2- 2e-=CO2 2e-=CO2 |
| B.工作时电子由电极a通过传感器流向电极b |
| C.工作时电极b作正极,O2-由电极a流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
关于下列各图的说法,正确的是
| A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 |
| B.②中待镀铁制品应与电源正极相连 |
| C.③中电子由b极流向a极 |
| D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |