题目内容
15.向含有NaCl和KCl共2.66g的溶液中加入过量的AgNO3溶液,共生成白色沉淀5.74g,求原溶液中NaCl和KCl的质量.分析 白色沉淀为AgCl,设NaCl和KCl的物质的量分别为xmol、ymol,根据二者总质量、氯离子守恒列方程计算NaCl和KCl的物质的量,再根据m=nM计算NaCl和KCl的质量.
解答 解:白色沉淀为AgCl,其物质的量为$\frac{5.74g}{143.5g/mol}$=0.04mol,
设NaCl和KCl的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.04}\\{58.5x+74.5y=2.66}\end{array}\right.$
解得x=y=0.02
故NaCl的质量为0.02mol×58.5g/mol=1.17g,
KCl的质量0.02mol×74.5g/mol=1.49g,
答:原溶液中NaCl的质量为1.17g,KCl的质量为1.49.
点评 本题考查混合物有关计算,难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
5.下列物质中,不含共价键的是( )
| A. | Na2S | B. | NH3 | C. | HClO | D. | Na2O2 |
6.常温下,CaSO4的沉淀溶解平衡曲线如图,Ksp(CaSO4)=9×10-6.下列判断错误的是( )

| A. | a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 | |
| B. | a点对应的Ksp等于c点对应的Ksp | |
| C. | b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol•L-1 | |
| D. | 向d点溶液中加入适量CaCl2固体可以变到c点 |
20.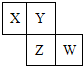 X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
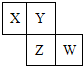 X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 非金属性:W>Z>Y | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物的稳定性:X>Y>Z | |
| D. | 最高正化合价:W>Z>X |
15.下列有关说法正确的是( )
| A. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| B. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 | |
| C. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 含1mol[Co(NH3)5Cl]Cl2的溶液与足量的AgNO3溶液混合,能生成2mol的AgCl沉淀 |