题目内容
【题目】钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为__________________。
(2)与CO互为等电子体的离子为__________(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有__________ 。
(4) C60用做比金属及其合金更为有效的新型吸氢材料,其分子结构中每一个C原子皆为SP2杂化,含多个σ键和π键,36gC60最多可以吸收标准状况下的氢气____________L。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是__________________ ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 _______________ 。
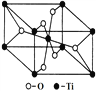
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如下图所示,则其中Ti4+的配位数为__________。
【答案】(1)3d24s2(2) CN-(或NO+、C22-) CO2(4)分子
(5)产生白色沉淀 [Co (NH3)5SO4]Br(6) 6
【解析】试题分析:(1)钛为22号元素,基态电子排布式为:[Ar]3d24s2,则基态钛原子的价电子排布式为3d24s2;
(2)CO为双原子分子,价电子总数为10,则CO的等电子体为离子的为:CN-(或NO+.C22-);
(3)在CH2Cl2、C6H6、CO2、C2H4中,分子构型分别为四面体形、平面正六边形、直线形、平面形,所以碳原子的杂化方式分别为sp3、sp2、sp、sp2杂化,采取sp杂化的分子有CO2;
(4)因TiCl4在常温下是无色液体,说明熔点低,在水或潮湿空气中易水解而冒白烟,说明钛离子为弱碱阳离子,由此可判断 TiCl4是由共价键结合的分子,晶体类型属于分子晶体;
(5)由[Co(NH3)5Br]SO4可知,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合成白色沉淀.加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,若加入AgNO3溶液时,产生淡黄色沉淀,说明溴离子在外界,因此另一配合物的化学式为[Co (NH3)5SO4]Br;
(6)观察晶胞结构,可知每个钛周围距离最近的氧原子有6个,即钛的配位数为6。

 阅读快车系列答案
阅读快车系列答案【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
实验中可能用到的数据:
密度/gcm-3 | 沸点/ ℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40 mL;
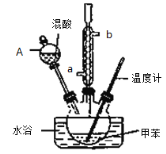
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制水浴温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15 g。
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许 ,目的是 。
(2)冷凝管的作用是 ;冷却水从冷凝管的_______(填“a”或“b”)端进入。
(3)仪器A的名称是 ,使用该仪器前必须进行的操作是_________________。
(4)分离反应后产物的方案如下:

其中,操作1的名称为 ,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和 、 。
(5)该实验中一硝基甲苯的产率为 (保留三位有效数字)。