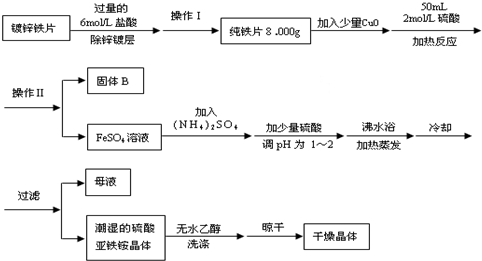
题目内容
 硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:
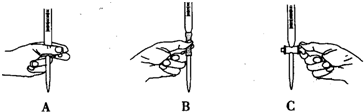
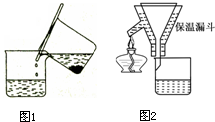
硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:步骤1:铁屑的处理.将废铁屑放入热的碳酸钠溶液中浸泡几分钟后用图1所示方法分离出固体并洗涤、干燥.步骤2:FeSO4溶液的制备.将处理好的铁屑放入锥形瓶,加入过量的3mol?L-1H2SO4溶液,加热至充分反应为止.趁热过滤(如图2所示),收集滤液和洗涤液.
步骤3:硫酸亚铁铵的制备.向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)步骤1中图1分离方法称为
倾析法
倾析法
法.(2)步骤2中有一处明显不合理的是
应该铁屑过量否则溶液中可能有Fe3+存在
应该铁屑过量否则溶液中可能有Fe3+存在
.趁热过滤的理由是减少溶质损失
减少溶质损失
.(3)步骤3加热浓缩过程中,当
浓缩至液体表面出现晶膜
浓缩至液体表面出现晶膜
时停止加热.用无水乙醇洗涤晶体的原因是硫酸亚铁铵晶体不溶于乙醇,乙醇可以除去其表面的水分
硫酸亚铁铵晶体不溶于乙醇,乙醇可以除去其表面的水分
.(4)FeSO4?7H2O在潮湿的空气中易被氧化成Fe(OH)SO4?3H2O,写出该反应的化学方程式
4[FeSO4?7H2O]+O2═4[Fe(OH)SO4?3H2O]+14H2O
4[FeSO4?7H2O]+O2═4[Fe(OH)SO4?3H2O]+14H2O
.分析:(1)分析装置1是倾析法;
(2)步骤2中加入过量铁粉防止Fe2+被氧化为Fe3+.溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失.
(3)加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体;
(4)FeSO4?7H2O在潮湿的空气中易被氧化成Fe(OH)SO4?3H2O,结合氧化还原反应电子守恒和原子守恒写出;
(2)步骤2中加入过量铁粉防止Fe2+被氧化为Fe3+.溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失.
(3)加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体;
(4)FeSO4?7H2O在潮湿的空气中易被氧化成Fe(OH)SO4?3H2O,结合氧化还原反应电子守恒和原子守恒写出;
解答:解:(1)步骤1中图1分离方法称为倾析法;
故答案为:倾析法;
(2)步骤2中加入过量铁粉防止Fe2+被氧化为Fe3+.溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失;
故答案为:应该铁屑过量,否则溶液中可能有Fe3+存在;减少溶质损失;
(3)加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体,硫酸亚铁铵晶体不溶于乙醇,可以用乙醇洗去晶体表面的水;
故答案为:浓缩至液体表面出现晶膜;硫酸亚铁铵晶体不溶于乙醇,乙醇可以除去其表面的水分;
(4)FeSO4?7H2O在潮湿的空气中易被氧化成Fe(OH)SO4?3H2O,结合氧化还原反应电子守恒和原子守恒写出化学方程式为:4[FeSO4?7H2O]+O2═4[Fe(OH)SO4?3H2O]+14H2O;
故答案为:4[FeSO4?7H2O]+O2═4[Fe(OH)SO4?3H2O]+14H2O;
故答案为:倾析法;
(2)步骤2中加入过量铁粉防止Fe2+被氧化为Fe3+.溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失;
故答案为:应该铁屑过量,否则溶液中可能有Fe3+存在;减少溶质损失;
(3)加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体,硫酸亚铁铵晶体不溶于乙醇,可以用乙醇洗去晶体表面的水;
故答案为:浓缩至液体表面出现晶膜;硫酸亚铁铵晶体不溶于乙醇,乙醇可以除去其表面的水分;
(4)FeSO4?7H2O在潮湿的空气中易被氧化成Fe(OH)SO4?3H2O,结合氧化还原反应电子守恒和原子守恒写出化学方程式为:4[FeSO4?7H2O]+O2═4[Fe(OH)SO4?3H2O]+14H2O;
故答案为:4[FeSO4?7H2O]+O2═4[Fe(OH)SO4?3H2O]+14H2O;
点评:本题考查了实验步骤的分析判断,物质制备的实验设计方法,性质验证,晶体析出方法的应用,题目难度中等.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4?FeSO4?6H2O,商品名称为莫尔盐,是一种复盐.一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定.与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体.三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品:Fe屑(含少量碳)、3mol/LH2SO4、( NH4)2SO4、蒸馏水、无水乙醇.
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是 ,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入 g(用含m1和m2的代数式表示,要求化简,下同.)水配制成室温下(20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止.放置冷却,得到硫酸亚铁铵的晶体,过滤后用 洗涤晶体.
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4?FeSO4?6H2O的质量分数?(列式计算)
| 温度/℃ | FeSO4?7H2O | (NH4)2SO4 | (NH4)2SO4?FeSO4?6H2O |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78.0 | 28.1 |
实验步骤流程图:

请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4?FeSO4?6H2O的质量分数?(列式计算)