题目内容
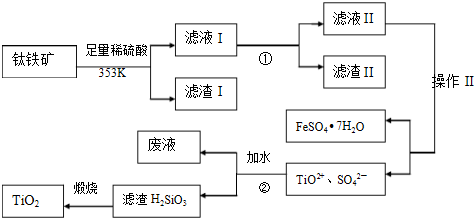
我国钛铁矿(主要成分为FeTiO3,还含有Al2O3、SiO2等)的储量居世界首位,用钛铁矿制取TiO2和副产品硫酸亚铁晶体的流程如下:
已知:Al(OH)3的Ksp=1.3×10-33,Fe(OH)2的Ksp=1.6×10-14.
(1)滤液I主要含有TiO2+、SO42-、Fe2+、 (填离子符号);
(2)调节pH应最好使用 ;
A.Fe B.Ca(OH)2 C.NH3?H2O D.NaOH
(3)操作Ⅱ是指 洗涤、干燥.
(4)步骤②中发生的化学反应方程式为: ;考虑成本和废物综合利用等因素,生产过程中产生的废液中应加入 处理较合理.
(5)实验室通常将硫酸亚铁进一步制备为硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]以利保存,制备方法被收入中学《实验化学》教材中;专家测定晶体含量的办法是:准确称取m g产品溶解定容至250.00mL,移取25.00mL于锥形瓶中,用c mol?L-1的标准KMnO4溶液滴定至 ,记录消耗KMnO4溶液的体积为V mL;此时发生的反应为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,(已知硫酸亚铁铵晶体的相对分子质量为392),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= .

已知:Al(OH)3的Ksp=1.3×10-33,Fe(OH)2的Ksp=1.6×10-14.
(1)滤液I主要含有TiO2+、SO42-、Fe2+、
(2)调节pH应最好使用
A.Fe B.Ca(OH)2 C.NH3?H2O D.NaOH
(3)操作Ⅱ是指
(4)步骤②中发生的化学反应方程式为:
(5)实验室通常将硫酸亚铁进一步制备为硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]以利保存,制备方法被收入中学《实验化学》教材中;专家测定晶体含量的办法是:准确称取m g产品溶解定容至250.00mL,移取25.00mL于锥形瓶中,用c mol?L-1的标准KMnO4溶液滴定至
分析:(1)根据钛铁矿的主要成分为FeTiO3,还含有Al2O3、SiO2等分析;
(2)调节pH时所用试剂只能与氢离子反应,不能与其它离子反应,也不能引入新的杂质;
(3)从溶液中提取溶质,应该先蒸发浓缩,再冷却结晶,最后洗涤干燥;
(4)步骤②中 TiOSO4发生水解反应生成H2TiO3,废液中含有硫酸,所以可加入碳酸钙处理;
(5)用标准KMnO4溶液滴定硫酸亚铁铵时,达到终点溶液为淡红色;先根据方程式求出硫酸亚铁铵的质量,再求出质量分数.
(2)调节pH时所用试剂只能与氢离子反应,不能与其它离子反应,也不能引入新的杂质;
(3)从溶液中提取溶质,应该先蒸发浓缩,再冷却结晶,最后洗涤干燥;
(4)步骤②中 TiOSO4发生水解反应生成H2TiO3,废液中含有硫酸,所以可加入碳酸钙处理;
(5)用标准KMnO4溶液滴定硫酸亚铁铵时,达到终点溶液为淡红色;先根据方程式求出硫酸亚铁铵的质量,再求出质量分数.
解答:解:(1)已知钛铁矿的主要成分为FeTiO3,还含有Al2O3、SiO2等,与稀硫酸反应后,滤液I主要含有TiO2+、SO42-、Fe2+、Al3+、H+,SiO2与稀硫酸不反应,
故答案为:Al3+、H+;
(2)调节pH时所用试剂只能与氢离子反应,不能与其它离子反应,也不能引入新的杂质,Ca(OH)2、NH3?H2O、NaOH都能与二价铁离子反应生成沉淀,同时会引入杂质,所以只能选择Fe来调节pH,
故答案为:A;
(3)从溶液中提取溶质,应该先蒸发浓缩,再冷却结晶,最后洗涤干燥,
故答案为:蒸发浓缩、冷却结晶;
(4)步骤②中 TiOSO4发生水解反应生成H2TiO3,其反应方程式为:TiOSO4+2H2O?H2TiO3+H2SO4;废液中含有硫酸,可加入碳酸钙能消耗硫酸,而且碳酸钙的来源较广,成本低,
故答案为:TiOSO4+2H2O?H2TiO3+H2SO4;碳酸钙;
(5)用标准KMnO4溶液滴定硫酸亚铁铵时,当溶液变为淡红色而且半分钟内不变色即是达到终点;
反应消耗的高锰酸钾为n(KMnO4)=c mol?L-1×V×10-3L=cV×10-3mol,已知发生的反应为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,则n(Fe2+)=5n(KMnO4)=5cV×10-3mol,所以原来晶体中所含硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]的物质的量为n=
×5cV×10-3mol=5cV×10-2mol,
所以硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]的质量为:m=nM=5cV×10-2mol×392g/mol,
故产品中硫酸亚铁铵晶体纯度为:
%;
故答案为:溶液显淡红色,半分钟内不变色;
%.
故答案为:Al3+、H+;
(2)调节pH时所用试剂只能与氢离子反应,不能与其它离子反应,也不能引入新的杂质,Ca(OH)2、NH3?H2O、NaOH都能与二价铁离子反应生成沉淀,同时会引入杂质,所以只能选择Fe来调节pH,
故答案为:A;
(3)从溶液中提取溶质,应该先蒸发浓缩,再冷却结晶,最后洗涤干燥,
故答案为:蒸发浓缩、冷却结晶;
(4)步骤②中 TiOSO4发生水解反应生成H2TiO3,其反应方程式为:TiOSO4+2H2O?H2TiO3+H2SO4;废液中含有硫酸,可加入碳酸钙能消耗硫酸,而且碳酸钙的来源较广,成本低,
故答案为:TiOSO4+2H2O?H2TiO3+H2SO4;碳酸钙;
(5)用标准KMnO4溶液滴定硫酸亚铁铵时,当溶液变为淡红色而且半分钟内不变色即是达到终点;
反应消耗的高锰酸钾为n(KMnO4)=c mol?L-1×V×10-3L=cV×10-3mol,已知发生的反应为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,则n(Fe2+)=5n(KMnO4)=5cV×10-3mol,所以原来晶体中所含硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]的物质的量为n=
| 250 |
| 25 |
所以硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]的质量为:m=nM=5cV×10-2mol×392g/mol,
故产品中硫酸亚铁铵晶体纯度为:
| 5×392cV |
| m |
故答案为:溶液显淡红色,半分钟内不变色;
| 5×392cV |
| m |
点评:本题考查了工艺流程图,涉及离子反应、水解原理、中和滴定原理等方面的知识,属于综合知识的考查,难度较大.

练习册系列答案
相关题目
| |||||||||||||||||||||||||||||
