题目内容
8.将100mL某未知浓度的AlCl3溶液分别加到600mL 0.1mol•L-1的NaOH溶液或600mL 0.3mol•L-1的NaOH溶液中,均能得到1.56g Al(OH)3沉淀.则此AlCl3溶液的浓度可能是( )| A. | 1 mol•L-1 | B. | 0.5 mol•L-1 | C. | 0.6 mol•L-1 | D. | 0.4 mol•L-1 |
分析 1.56g Al(OH)3沉淀的物质的量为$\frac{1.56g}{78g/mol}$=0.02mol,氢氧化铝中n(OH-)=0.06mol,600mL 0.1mol•L-1的NaOH溶液中n(NaOH)=0.6L×0.1mol•L-1=0.06mol,600mL 0.3mol•L-1的NaOH溶液中n(NaOH)=0.6L×0.3mol•L-1=0.18mol,根据氢氧根的物质的量可知,加到600mL 0.1mol/LNaOH溶液中只发生Al3++3OH-═Al(OH)3↓,氯化铝有剩余,加到600mL 0.3mol/LNaOH溶液中发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,以此来计算解答.
解答 解:1.56g Al(OH)3沉淀的物质的量为$\frac{1.56g}{78g/mol}$=0.02mol,氢氧化铝中n(OH-)=0.06mol,600mL 0.1mol•L-1的NaOH溶液中n(NaOH)=0.6L×0.1mol•L-1=0.06mol,600mL 0.3mol•L-1的NaOH溶液中n(NaOH)=0.6L×0.3mol•L-1=0.18mol,根据氢氧根的物质的量可知,加到600mL 0.1mol/LNaOH溶液中只发生Al3++3OH-═Al(OH)3↓,氯化铝有剩余,加到600mL 0.3mol/LNaOH溶液中发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,
设此AlCl3溶液的溶质的物质的量为xmol,则:
Al3++3OH-═Al(OH)3↓
x 3x x
Al(OH)3+OH-═AlO2-+2H2O
x-0.02 x-0.02
根据消耗的碱的物质的量可知,3x+(x-0.02)=0.6×0.3,解得x=0.05mol,
此AlCl3溶液的浓度为$\frac{0.05mol}{0.1L}$=0.5mol/L,
故选B.
点评 本题考查化学方程式有关计算,关键是根据氢氧根的物质的量判断氯化铝在两不同浓度氢氧化钠溶液中反应情况,难度中等.

| A. | 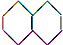 (2组) | B. | 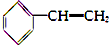 (5组) | C. | 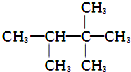 (3组) (3组) | D. | 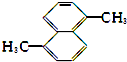 (4组) (4组) |
| A. | pH=1的溶液中:K+、Cr2O72-、CH3CH2OH、SO42- | |
| B. | 加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- | |
| D. | 含有较多Al3+的溶液:HCO3-、K+、Na+、Cl- |
| A. | 化学电源均是根据原电池的工作原理设计的 | |
| B. | 反应A+B=C+D为吸热反应,则A的能量高于物质具有的能量 | |
| C. | 石墨转化为金刚石时要吸热,则说明石墨比金刚石稳定 | |
| D. | 燃料电池是一种高效、环保的新型化学电源 |
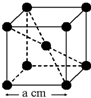 已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )| A. | NA•a3•ρ | B. | $\frac{{N}_{A}•{a}^{3}•ρ}{6}$ | C. | $\frac{{N}_{A}•{a}^{3}•ρ}{4}$ | D. | $\frac{{N}_{A}•{a}^{3}•ρ}{2}$ |
| A. | 为提高成绩,可允许运动员在体育比赛中服用麻黄碱 | |
| B. | 毒品是指由于非医疗目的而反复使用使人产生成瘾性的药品,如吗啡、冰毒等 | |
| C. | 阿司匹林可以减轻感冒引起的头痛,但不能大量服用 | |
| D. | 用青霉素前一定要进行皮肤试验 |
| A. | 实验室用大理石和稀盐酸制取CO2:CO32-+2H+═CO2↑+H2O | |
| B. | 碳酸钠溶液呈碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
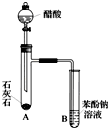 某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置,请回答下列问题:
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置,请回答下列问题: