题目内容
【题目】常温下,浓度均为1.0mol/L的HX溶液、HY溶液,分别加水稀释.稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是

A. HX是强酸,溶液每稀释10倍.pH始终增大l
B. 常温下HY的电离常数为1.0×10-4
C. 溶液中水的电离程度:a 点大于b 点
D. 消耗同浓度的NaOH溶液体积:a 点大于b 点
【答案】B
【解析】A.图象中1.0mol/L的HX溶液PH=1说明为强酸,加水稀释溶液PH最终接近7,溶液每稀释10倍,pH增大不一定是1,故A错误;B.1.0mol/LHY溶液PH=2,c(H)=10-2mol/L,结合定量平衡常数K=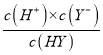 =
=![]() ≈1×10-4,故B正确;
≈1×10-4,故B正确;
C.HX为强酸,HY为弱酸,加水稀释相同倍数,a点HX溶液中氢离子浓度大于b点HY,溶液中水的电离程度:a点小于b点,故C错误;D.a点和b点分别为相同浓度和相同体积的HX和HY分别稀释相同的倍数后所得溶液,两溶液中n(HX)=n(HY),则中和时消耗的NaOH溶液体积相同,故D错误;答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】回答下列问题
(1)现有下列十种物质:①O2;②Fe;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁胶体;⑧硫酸钠溶液;⑨稀硝酸;⑩Cu2(OH)2CO3 . (i)按物质的树状分类法填写表格的空白处:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | ⑧⑨ |
(ii)上述物质中属于非电解质的有;上述物质中能与盐酸反应的电解质有(填序号).
(2)(i)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是 , 还原产物是 , 氧化产物与还原产物的质量比是 . (ii)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2 , 转移的电子的物质的量为mol.
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1


