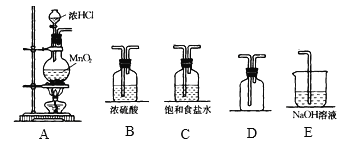
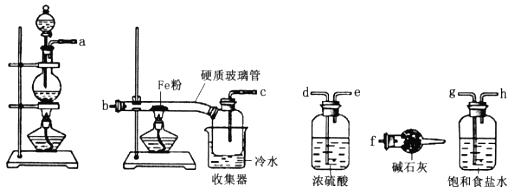
题目内容
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液(醋酸二氨合铜、氨水)吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac (Ac-为CH3COO-的简写)
[Cu(NH3)3CO]Ac (Ac-为CH3COO-的简写)
(1)基态原子中未成对电子数最多的短周期元素X,与上述反应中所有元素均不在同一周期,该基态原子的电子排布式为________。
(2) [Cu(NH3)3CO]Ac组成元素中,第一电离能最大的元素是________。(填元素符号)。
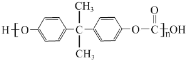
(3)HAc可通过将CH3CHO氧化得到,比较HAc与乙醛的沸点高低,并说明原因:________________。
(4)C、N两种原子可形气体分子 (CN)2,也可形成有剧毒性的CN-。(CN)2性质与卤素单质类似,判断(CN)2中C原子轨道杂化类型为________。与CN-互为等电子体的一种非极性分子的化学式为________。
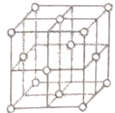
(5)铜晶胞结构如图,铜晶体中每个铜原子周围距离最近的铜原子数目为________。
 。
。
【答案】1s22s22p63s23p3 N 乙酸,主要原因是乙酸分子间存在氢键,而乙醛分子间不存在氢键 sp N2 12
【解析】
(1)反应中涉及的元素有H、C、N、O、Cu,X与上述反应中所有元素均不在同一周期,则X在第三周期元素,基态原子中未成对电子数最多的短周期元素X是磷,是15号元素,3p轨道为半充满状态,核外电子排布式1s22s22p63s23p3;
(2)H、C、N、O、Cu元素中,C、N、O位于同周期,同周期从左到右,第一电离能呈现增大的趋势,但N的2p轨道为半充满,第一电离能比相邻原子大;Cu是位于第四周期的元素,电离能较小;H位于第一周期元素,电离能也较小,故N的第一电离能最大;
(3)乙酸中含有羧基,乙醛中含有醛基,HAc的沸点高于乙醛,主要原因是乙酸分子间存在氢键,而乙醛分子间不存在氢键;
(4)(CN)2性质与卤素单质类似,应该为直线型分子,C原子轨道杂化类型为sp杂化;
与CN-互为等电子体的一种分子为2个原子,最外层电子数为10个,属于非极性分子的化学式为N2;
(5)以上底面中心的铜原子为研究对象,距离最近的铜原子位于上底面的顶点,共有4个铜原子,上下晶胞的侧面的面心位置各有4个铜原子,共有12个铜原子与上底面的铜原子距离最近。

【题目】外循环三相反应器连续制备高锰酸钾新技术是目前高锰酸钾工业发展的主要方向。该法以软锰矿(主要成分为MnO2)为原料生产高锰酸钾。该工艺路线制备高锰酸钾如下:
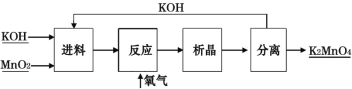
![]()
已知:一些化合物溶解度(单位:g)随温度的变化如表
温度℃ | KMnO4 | KCl | K2CO3 |
20 | 6.4 | 34.0 | 52.5 |
90 | 45.2 | 56.7 | 60.9 |
回答下列问题:
(1)原料软锰矿与氢氧化钾按一定的比例在“进料”时加热熔融后再和氧气进行“反应”,“进料”前应将软锰矿粉碎,其作用是____。
(2)“反应”中发生反应的化学方程式为____。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即向溶液中通入CO2气体,使体系呈中性或弱碱性。
K2MnO4发生歧化反应时,能否用盐酸代替CO2____(请填写“能”或“不能”)。待锰酸钾全部歧化后,静置一段时间后过滤。从滤液中得到高锰酸钾晶体的操作是:____。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为____,电解产物____可以循环利用。
③“CO2歧化法”和“电解法”相比较,K2MnO4的理论利用率之比为____。