题目内容
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中: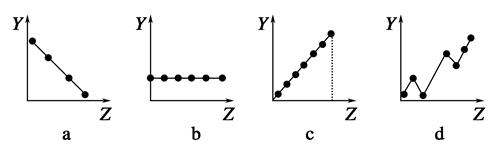
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为________(名称),Y为________(元素符号),Z原子结构示意图为________。
②N的最高价氧化物的水化物的化学式为__________。
③工业上制取单质M的化学方程式为______________。
(1)①b ②c ③a
(2)①氢 O  ②HClO4 ③SiO2+2C
②HClO4 ③SiO2+2C Si+2CO↑
Si+2CO↑
解析

练习册系列答案
相关题目
下表为元素周期表的一部分,请回答有关问题:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | | ③ | ④ | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
(1)⑤和⑧的元素符号分别是__________和__________。
(2)表中最活泼的金属是__________,非金属性最强的元素是__________。(填写元素符号)
(3)表中能形成两性氢氧化物的元素是__________,分别写出该元素的氢氧化物与⑥和⑨最高价氧化物的水化物反应的化学方程式:______________________________, ________________________________。
(4)请设计一个实验,比较⑦⑩单质氧化性的强弱:
_________________________________________________________________。
A、B、C为短周期元素,在周期表中所处的位置如图所示。
| A | | C |
| | B | |
(1)写出A、B元素的名称________、________。
(2)B位于元素周期表中第________周期第________族。
(3)C的原子结构示意图为________。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式________________________________________________________________。
已知某物质主要成分的化学式为XY2,X原子的结构示意图为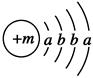 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该物质主要成分的化学式为________。
(2)Z、W元素的名称为________、________。
(3)下列说法正确的是________。
| A.XY2和WZ2都为离子化合物 |
| B.XY2分子中仅含离子键,WZ2中仅含极性共价键 |
| C.H2Z比HY的稳定性强 |
| D.X的阳离子比Y的阴离子半径大 |

(5)水的沸点比H2Z的沸点高,其原因是_________________________________________。
用
| A.质子数、 | B.中子数、 | C.最外层电子数、 | D.电子层数填写下列空格。 |
(2)元素种类由________决定。
(3)元素有无同位素由________决定。
(4)1~18号元素的化合价主要由________决定。
(5)元素的化学性质由________决定。