题目内容
【题目】关于CO2和CO32-的下列说法正确的是 ( )
A.两种微粒的中心原子均无孤电子对B.两种微粒价层电子对数相同
C.键角:CO32-> CO2D.两种微粒的中心原子杂化方式相同
【答案】A
【解析】
CO2价层电子对数为![]() ,无孤对电子对,空间构型为直线型;CO32-的层电子对数为
,无孤对电子对,空间构型为直线型;CO32-的层电子对数为![]() ,无孤对电子对,空间构型为平面三角形。
,无孤对电子对,空间构型为平面三角形。
A.根据分析,CO2和CO32-均为孤对电子对,A正确;
B.CO2的价层电子对数为2,而CO32-的价层电子数为3,价层电子对数不同,B错误;
C.CO2为直线型分子,键角为180°,CO32-为平面三角形,键角为120°,C错误;
D.CO2中的C的杂化类型为sp,CO32-中C的杂化类型为sp2,D错误。
答案选A。

练习册系列答案
相关题目
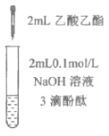
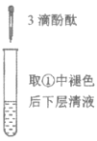
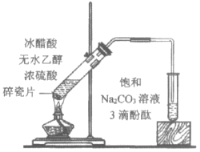
【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸