题目内容
12.下列有关说法中不正确的是( )| A. | Al(OH)3在用于治疗胃酸过多类疾病时表现出弱碱性 | |
| B. | 明矾溶于水后可得到少量的有强吸附性的Al(OH)3,故明矾可作净水剂 | |
| C. | Al(OH)3可用于中和馒头制作过程(如发酵阶段)中产生的酸 | |
| D. | Al2O3可用于制作耐火材料而Al(OH)3不能 |
分析 A、根据氢氧化铝与盐酸反应分析;
B、根据明矾净水的原理是氢氧化铝净水来分析;
C、根据Al(OH)3与酸反应生成水,不能生成二氧化碳气体判断;
D、Al2O3耐高温,可用作耐火材料,Al(OH)3受热易分解.
解答 解:A、因为氢氧化铝与盐酸反应,所以Al(OH)3在用于治疗胃酸过多类疾病时表现出弱碱性,故A正确;
B、明矾净水的原理是:Al3++3H2O=Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水,故B正确;
C、因为Al(OH)3与酸反应生成水,不能生成二氧化碳气体,所以Al(OH)3不能用于中和馒头制作过程(如发酵阶段)中产生的酸,故C错误.
D、Al2O3耐高温,可用作耐火材料,Al(OH)3受热易分解,则不能用于制作耐火材料,故D正确.
故选:C.
点评 本题主要考查了氢氧化铝的性质和用途,主要是常见物质在生产生活中的具体用途、常见物质的制备及发生的化学反应方程式等方面的知识,题目较简单.

练习册系列答案
相关题目
2.在溶液中加入足量的Na2O2后仍能大量共存的是( )
| A. | NH4+、NO3-、Ba2+、Cl- | B. | K+、SO42-、Cl-、AlO2- | ||
| C. | NO3-、HCO3-、Ca2+、Mg2+ | D. | Cl-、Na+、CO32-、SO32- |
3.化学与生产、生活、环境密切相关.下列有关说法中不正确的是( )
| A. | 燃煤时加入适量生石灰,可减少废气中SO2的排放量 | |
| B. | 氨是制造硝酸、铵盐和纯碱的原料 | |
| C. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| D. | SiC俗称金刚砂,可用作砂纸、砂轮的磨料 |
20.下列分子中划横线的原子采取的杂化方式为sp杂化的是( )
| A. | CH4 | B. | C2H4 | C. | C2H2 | D. | NH3 |
7.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,20g D2O和足量的金属钠反应产生气体的分子数为0.5NA | |
| B. | 1mol Na2O2与足量的水反应,转移的电子数为2NA | |
| C. | 含1mol H2O的冰中,氢键的数目为4NA | |
| D. | 常温常压下,124g P4有P-P键的数目为12NA |
17.蓄电池在放电时起原电池的作用,在充电时起电解池的作用.下面是爱迪生蓄电池分别在充电和放电时发生的反应:Fe+NiO2+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH),下列有关爱迪生蓄电池的推断错误的是( )
| A. | 放电时,Fe是负极,NiO2是正极 | |
| B. | 蓄电池的电极可以浸入某种碱性电解质溶液中 | |
| C. | 充电时,阴极上的电极反应为:Fe(OH)2+2e-=Fe+2OH- | |
| D. | 放电时,电解质溶液中的阴离子向正极方向移动 |
1.水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14.则下列叙述正确的是( )
| A. | 水的电离是一个放热过程 | |
| B. | 35℃时,c(H+)>c(OH-) | |
| C. | 25℃时,pH=3的盐酸中由水电离产生的c(OH-)=1.0×10-3mol/L | |
| D. | 25℃时,向溶液中加入稀氨水,平衡逆向移动,Kw不变 |
2.可逆反应aA(g)+bB(g)?cC(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列关系式中能说明反应已达到平衡状态的是( )
| A. | av正(A)=bv正(B) | B. | bv正(A)=av逆(B) | C. | av正(C)=cv正(A) | D. | av正(A)=bv逆(B) |
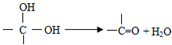 ,如图中X分子式为C4H2Br2O4,为六元环化合物,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰.
,如图中X分子式为C4H2Br2O4,为六元环化合物,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰.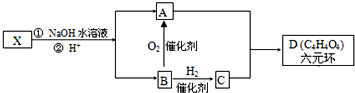
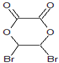 .它可以发生ab反应(填字母)a、取代 b、消去c、加成
.它可以发生ab反应(填字母)a、取代 b、消去c、加成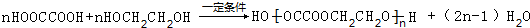 .
.