题目内容
10.下类物质的使用,不利于人体健康的是( )| A. | 食醋用作调味剂 | B. | 碳酸钙用作补钙剂 | ||
| C. | 食品包装袋中填充氮气防腐 | D. | 用大量防腐剂保存牛奶 |
分析 A.食醋有酸味;
B.碳酸钙与胃酸能反应生成可溶性盐氯化钙;
C.因为氮气化学性质不活泼,可以隔绝氧气;
D.防腐剂能对人体产生危害.
解答 解:A.食醋是生活中常用的调味剂,故A正确;
B.碳酸钙与胃酸能反应生成可溶性盐氯化钙能被人体吸收,故B正确;
C.因为氮气化学性质不活泼,可以隔绝氧气,所以可用于食品包装袋内防腐,故C正确;
D.防腐剂过量,会对人的健康产生影响,故D错误.
故选D.
点评 本题综合考查常见物质的性质、用途和适用范围,知道碳酸钙与胃酸能反应生成可溶性盐氯化钙能被人体吸收,氮气化学性质不活泼,可以隔绝氧气、亚硝酸盐及二氧化硫是常用的防腐剂之一,防腐剂过量,会对人的健康产生影响,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列说法正确的是( )
| A. | 用倾析法分离沉淀时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离 | |
| B. | 做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| C. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
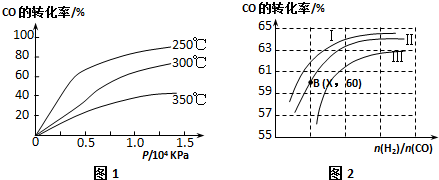
15.Ⅰ:水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得.己知:
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
C (s)+$\frac{1}{2}$O2(g)=CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)=CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (g);△H=-241.8kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (l);△H=-285.8kJ•mo1-1
Ⅰ:(1)将2.4g 炭转化为水煤气,再完全燃烧生成液态水,整个过程的△H=-78.7kJ•mo1-1.
(2)由CO、H2在一定条件下可获得汽油的替代品--甲醇,甲醇的燃烧热为-726.5kJ/mol,试写出由CO、H2生成甲醇的热化学方程式CO(g)+2H2(g)═CH3OH(l)△H=-128.1 kJ/mol.
Ⅱ:在1L的密闭容器中,进行反应到:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
(3)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01mol、0.01mol、0.01mol、0.01mol.则反应CO2(g)+H2(g)?CO(g)+H2O(g)向逆反应 (填“正反应”或“逆反应”)方向进行,其依据是Qc=$\frac{c(CO)×c(H2O)}{c(CO2)×c(H2)}$=1>0.9=K.
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
C (s)+$\frac{1}{2}$O2(g)=CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)=CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (g);△H=-241.8kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)=H2O (l);△H=-285.8kJ•mo1-1
Ⅰ:(1)将2.4g 炭转化为水煤气,再完全燃烧生成液态水,整个过程的△H=-78.7kJ•mo1-1.
(2)由CO、H2在一定条件下可获得汽油的替代品--甲醇,甲醇的燃烧热为-726.5kJ/mol,试写出由CO、H2生成甲醇的热化学方程式CO(g)+2H2(g)═CH3OH(l)△H=-128.1 kJ/mol.
Ⅱ:在1L的密闭容器中,进行反应到:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| T(℃) | 700 | 800 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.7 | 2.6 |
2.关于海水综合利用问题,下列说法错误的是( )
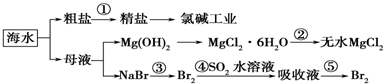

| A. | 从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程 | |
| B. | 在过程②中若要获得无水MgCl2不可直接蒸干灼烧 | |
| C. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| D. | 第③④步的目的是为了浓缩富集溴 |
19.实验室使用容量瓶来配置一定体积、一定浓度的溶液.下列有关容量瓶的叙述错误的是( )
| A. | 容量瓶上标有容量瓶的规格和温度 | |
| B. | 容量瓶瓶颈只有一个刻度线 | |
| C. | 容量瓶不能用作溶解的容器 | |
| D. | 为防止热溶液蒸发时损失水分,应立即将热溶液转移到容量瓶中 |