题目内容
10.下列说法正确的是(NA表示阿伏加德罗常数)( )①28g N2所含有的原子数为2NA
②在常温常压下,11.2L N2含有的分子数为0.5NA
③34g氨气所含分子数为2NA
④标准状况下,1L水所含分子数为$\frac{1}{22.4}$NA.
| A. | ①③ | B. | ①② | C. | ③④ | D. | ②④ |
分析 ①氮气由氮原子构成;
②常温常压下,气体摩尔体积大于22.4L/mol;
③根据分子数N=$\frac{m}{M}{N}_{A}$来计算;
④标况下,水为液态.
解答 解:①氮气由氮原子构成,故28g氮气中含有的氮原子的物质的量n=$\frac{28g}{14g/mol}$=2mol,即为2NA个,故①正确;
②常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,故分子个数小于0.5NA个,故②错误;
③34g氨气中的分子数N=$\frac{m}{M}{N}_{A}$=$\frac{34g}{17g/mol}{N}_{A}$=2NA,故③正确;
④标况下,水为液态,不能根据气体摩尔体积来计算其物质的量,故④错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.某同学做Na、Mg、Al元素金属性递变规律实验时,设计了一套实验方案,记录了有关实验现象.
(1)实验内容:(填写与实验步骤对应的实验现象的编号)
(2)写出实验①、②对应化学方程式
实验①;Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑
实验②;2Na+2H2O=2NaOH+H2↑
(3)实验结论:第三周期的金属性:Na>Mg>Al.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A-D) |
实验①;Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑
实验②;2Na+2H2O=2NaOH+H2↑
(3)实验结论:第三周期的金属性:Na>Mg>Al.
18.已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如下:
(1)通过表格中的数值可以推断:反应①是吸热(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:
K3=$\frac{[CO][{H}_{2}O]}{[{H}_{2}][C{O}_{2}]}$.
(3)能判断反应③已达平衡状态的是BC.
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式.据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是DF(填写序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(5)若反应③的逆反应速率与时间的关系如图所示:

若反应在t2、t4、t6、t8时各只改变了一种条件(浓度、压强、温度、催化剂),试判断如何改变的条件:t2时升高温度; t4时降低压强.
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:
K3=$\frac{[CO][{H}_{2}O]}{[{H}_{2}][C{O}_{2}]}$.
(3)能判断反应③已达平衡状态的是BC.
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式.据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是DF(填写序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(5)若反应③的逆反应速率与时间的关系如图所示:

若反应在t2、t4、t6、t8时各只改变了一种条件(浓度、压强、温度、催化剂),试判断如何改变的条件:t2时升高温度; t4时降低压强.
5.下列关于油脂的说法中,不正确的是( )
| A. | 油脂水解后的产物经氧化为人体提供热能 | |
| B. | 油脂能溶解维生素A、D、E、K | |
| C. | 油脂能储备热能 | |
| D. | 多吃动物脂肪比多吃植物油好 |
15.下列说法正确的是( )
| A. | O2-的结构示意图为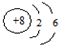 | |
| B. | 某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子 | |
| C. | NH4+与H3O+具有相同的质子数和电子数 | |
| D. | F-、Na+、Mg2+、Al3+是与He原子具有相同电子层结构的离子 |
2.下列说法正确的是( )
| A. | 用玻璃棒蘸取1 mol.L-lCH3 COOH溶液,点在广范pH试纸中部,与标准比色卡对照,测得其pH为3.5 | |
| B. | 用玻璃棒蘸取皂化反应后的混合液,滴入装有热水的试管中,振荡、静置,若有油滴浮在液面上,说明反应液中油脂已完全水解 | |
| C. | 取5 mL SO2水溶液,滴加BaCl2溶液,立即出现白色沉淀,加入盐酸,沉淀消失 | |
| D. | 取5 mL 0.1 mol•L-1KI溶液,加入0.1 mol•L-l FeCl3溶液1 mL,充分反应后继续加入2mLCCl4,振荡、静置后取上层溶液滴加KSCN溶液,溶液变红色 |
20.下表中的实验操作不能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液 | 检验H2O2的氧化性大于Fe3+ |
| B | 将气体通入稀溴水中 | 检验SO2 中是否混有乙烯 |
| C | 滴入紫色石蕊试液 | 检验酒精中是否混有醋酸 |
| D | 用饱和碳酸钠溶液洗涤后分液 | 除去乙酸乙酯中少量的乙醇和乙酸 |
| A. | A | B. | B | C. | C | D. | D |