题目内容
一种由甲醇、氧气和强碱溶液(作电解质)组成的新型手机电池,可持续使用一个月,其电池反应为: ,则有关说法正确的是
,则有关说法正确的是
 ,则有关说法正确的是
,则有关说法正确的是| A.放电时CH3OH参与反应的电极为正极 |
| B.放电时负极的电极反应为CH3OH+8OH-→CO+6H2O+6e- |
| C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移 |
| D.放电一段时间后,通入氧气的电极附近溶液的pH降低 |
B
根据总反应可看出,甲醇被氧气氧化
正极氧气得电子发生还原反应:O2+4e-+2H2O=4OH-
甲醇在负极失电子被氧化:CH3OH+8OH-→CO32—+6H2O+6e-(总反应减去负极反应即可得到)
由正极电极反应可知,标准状况下,通入5.6 L O2(0.25mol)并反应后,有1mol电子转移,在正极处生成了OH-,碱性增强,pH升高
故答案为B
正极氧气得电子发生还原反应:O2+4e-+2H2O=4OH-
甲醇在负极失电子被氧化:CH3OH+8OH-→CO32—+6H2O+6e-(总反应减去负极反应即可得到)
由正极电极反应可知,标准状况下,通入5.6 L O2(0.25mol)并反应后,有1mol电子转移,在正极处生成了OH-,碱性增强,pH升高
故答案为B

练习册系列答案
相关题目
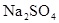 试液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是:( )
试液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是:( )
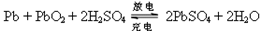 ,下列说法正确的是
,下列说法正确的是 
 2PbSO4+2H2O;据此判断:
2PbSO4+2H2O;据此判断: