题目内容
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:

(1)用(NH4)2SO4与NH3·H2O物质的量之比为1∶2的混合溶液浸取锌焙砂时,生成[Zn(NH3)4]2+,该反应的离子方程式是 。浸取过程加入H2O2的目的是 。
(2)适量S2-能将Cu2+等离子转化为硫化物沉淀而除去,若选择置换的方法除杂,则应加入的物质为 。
(3)气体A的化学式是 。
(4)过滤3所得滤液可循环使用,其主要成分的化学式是 。证明2Zn(OH)2·ZnCO3沉淀洗涤完全的方法是 。
(5)为实现循环生产,下列物质中可以用来代替(NH4)2S完成除杂的是 。(填字母)
a.Na2S b.K2S c.BaS
【答案】(1)ZnO + 2NH4++ 2NH3·H2O = [Zn(NH3)4]2++ 3H2O 将Mn2+氧化为MnO2除去
(2)Zn (3)CO2
(4)(NH4)2SO4
取最后一次洗涤液少许于试管中,滴加稀盐酸和BaCl2溶液,若无明显现象,则已洗涤干净。
(5)c
【解析】试题分析:制备2Zn(OH)2ZnCO3流程为:锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)中加入硫酸铵、氨水、双氧水,双氧水将锰离子氧化成二氧化锰,过滤后在滤液中加硫化铵,再过滤,除去铜离子,蒸氨除去多余的氨气,加入碳酸氢铵得到2Zn(OH)2ZnCO3和二氧化碳气体,过滤得2Zn(OH)2ZnCO3,滤液为硫酸铵溶液,
(1)用(NH4)2SO4与NH3H2O物质的量之比为1:2 的混合溶液浸取锌焙砂时,生成[Zn(NH3)4]2+,反应的离子方程式为ZnO+2NH4++2NH3H2O=[Zn(NH3)4]2++3H2O,双氧水将锰离子氧化成二氧化锰而除去锰;
(2)根据流程可知,要制备制备2Zn(OH)2ZnCO3,所以要置换出铜,可以用锌;
(3)根据上面的分析可知A的化学式为CO2;
(4)根据上面的分析可知,过滤3所得滤液为硫酸铵溶液,化学式为(NH4)2SO4,证明2Zn(OH)2ZnCO3沉淀洗涤完全即证明沉淀洗涤滤液中有没有硫酸根离子,操作为取最后一次洗涤液少许于试管中,滴加稀盐酸和BaCl2溶液,若无明显现象,则已洗涤干净,
(5)用Na2S或K2S代替(NH4)2S都会给溶液带来杂质,BaS中的硫离子在后继的步骤中可被沉淀,答案选c;

【题目】已知,常温下H2S、H2CO3 的电离常数如下表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常温下,0.1mol/L的硫化钠溶液和0.1mol.L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
② 常温下,硫化钠水解的离子方程式_____________________________。
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子。
①常温下,NaHS溶液显______(选填“酸性”、“中性”或“碱性”)
②常温下,向100 mL 0.1 mol·L-1 H2S溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
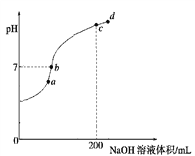
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)_______________;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是___________。
