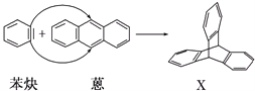
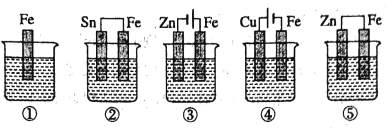
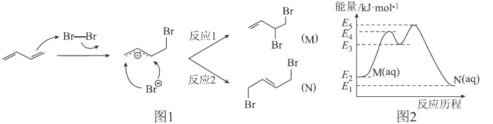
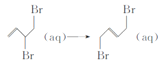
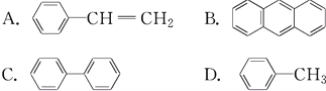题目内容
【题目】四种短周期元素的性质或结构信息如下表所示。请根据信息回答下列问题。
元素 | T | X | Y | Z |
性质或结构信息 | 原子核外s能级上的电子总数等于p能级上的电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 其单质为双原子分子,分子中含有3对共用电子对,常温下其气体单质性质稳定,但其原子较活泼 | 其单质质软,是银白色固体,导电性强。单质在空气中燃烧发出黄色火焰 | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图:______;写出元素X的气态氢化物的分子式:______;写出Z元素原子的核外电子排布式:________;元素Y的原子核外共有_______种形状不同的电子云。
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式:______。
(3)元素T与氟元素相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是___(填字母)。
a.常温下氟气的颜色比T单质的深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素显正价
d.比较两元素的单质与氢气化合时得电子的数目
【答案】![]() NH3 1s22s22p63s23p1 2 2Al+2OH-+2H2O=2AlO2-+3H2↑ F bc
NH3 1s22s22p63s23p1 2 2Al+2OH-+2H2O=2AlO2-+3H2↑ F bc
【解析】
T原子核外s电子总数等于p电子总数,且T是人体内含量最多的元素,其单质是常见的助燃剂,可以推得T元素为O;X的单质为双原子分子,分子中含有3对共用电子对,常温下X的气体单质性质稳定,但其原子较活泼,可以推得X元素为N;Y元素的单质质软,是银白色固体,导电性强,单质在空气中燃烧发出黄色火焰,推得Y元素为Na;Z元素在第三周期元素中,其简单离子的半径最小,可知Z元素为Al,据此解答。
(1)元素T的离子为O2-,结构示意图为![]() ;元素X的气态氢化物为氨气,分子式为NH3;Al元素原子的核外电子排布式为1s22s22p63s23p1;Na元素的原子核外共有有s、p两种电子轨道,对应2种形状不同的电子云;故答案为:
;元素X的气态氢化物为氨气,分子式为NH3;Al元素原子的核外电子排布式为1s22s22p63s23p1;Na元素的原子核外共有有s、p两种电子轨道,对应2种形状不同的电子云;故答案为:![]() ;NH3;1s22s22p63s23p1;2;
;NH3;1s22s22p63s23p1;2;
(2)Z单质与Y最高价氧化物的水化物的水溶液反应,即Al与NaOH溶液反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)氧元素与氟元素相比,非金属性较强的是F,a.常温下氟气的颜色比氧气的深,不能说明非金属性强弱,故a不选;b.氟气与水剧烈反应,产生氧气,从氧化还原反应规律可得,氧化性:F2>O2,则非金属性:F>O,故b选;c.氟与氧形成的化合物中氧元素显正价,说明氟原子得电子能力强于氧,即非金属性:F>O,故c选;d.两元素的单质与氢气化合时得电子的数目与非金属性强弱无关,故d不选;故答案为:bc。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案