题目内容
【题目】锂离子电池历经半个世纪岁月的考验,作出重大贡献的三位科学家被授予2019 年诺贝尔化学奖。磷酸亚铁锂( LiFePO4)是新型锂离子电池的正极材料。某小组拟设计以一种锂辉石(主要成分为Li2O· Al2O3·4SiO2,含少量铁、钙、镁)为原料制备纯净的碳酸锂,进而制备LiFePO4的工艺流程:
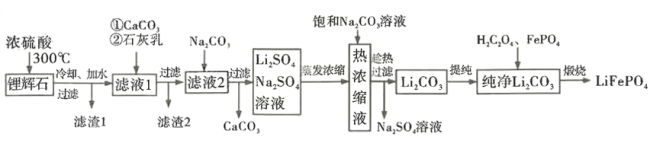
已知:LiO2·Al2O3·4SiO2+H2SO4(浓) ![]() Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
回答下列问题:
(1) LiFePO4含有锂、铁两种金属元素,它们焰色反应的颜色分别是_____________(填序号)。
A.紫红色、无焰色反应 B.黄色、无焰色反应
C.黄色、紫色 D.洋红色、黄绿色
(2)滤渣1的主要成分是_____________;向滤液1中加入适量的CaCO3细粉用于消耗硫酸并将Fe3+转化为红褐色沉淀,若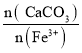 =3,反应的离子方程式为__________; 滤渣2的主要成分是Fe(OH)3、________、 CaSO4,其中 Fe(OH)3 脱水后可生成一种元素种类不变且摩尔质量为89 g·mol -1的新化合物,其化学式为_______________。
=3,反应的离子方程式为__________; 滤渣2的主要成分是Fe(OH)3、________、 CaSO4,其中 Fe(OH)3 脱水后可生成一种元素种类不变且摩尔质量为89 g·mol -1的新化合物,其化学式为_______________。
(3)已知碳酸锂在水中的溶解度随温度升高而减小,上述流程中趁热过滤的目的是________。
(4)煅烧制备LiFePO4时,反应的化学方程式为_____________________。
(5)某种以LiFePO4,作正极材料的锂电池总反应可表示为: LiFePO4+C![]() Li1-xFePO4 +CLix。放电时正极的电极反应式为__________。
Li1-xFePO4 +CLix。放电时正极的电极反应式为__________。
【答案】A Al2O3·4SiO2·H2O Fe3++3H++3CaCO3= Fe(OH)3+3Ca2++3CO2↑或Fe3++3H++3CaCO3+3SO42-= Fe(OH)3+3CaSO4+3CO2↑ Mg(OH)2 FeO(OH)或FeOOH 减小LiCO3的溶解损失 Li2CO3+H2C2O4+2FePO4![]() 2LiFePO4+3CO2↑+H2O↑ Li1-xFePO4+xLi++xe- =LiFePO4
2LiFePO4+3CO2↑+H2O↑ Li1-xFePO4+xLi++xe- =LiFePO4
【解析】
锂辉石(主要成分为Li2O· Al2O3·4SiO2,含少量铁、钙、镁)加入浓硫酸共热,根据已知信息可知得到的沉淀1主要成分为Al2O3·4SiO2·H2O,滤液中的主要阳离子有Fe3+、Mg2+、Ca2+、Li+;加入碳酸钙和石灰乳可以将过量的氢离子和Fe3+、Mg2+除去,滤渣2主要为Fe(OH)3、Mg(OH)2以及硫酸钙;滤液主要杂质离子有Ca2+和SO42-;再加入碳酸钠将钙离子除去,得到硫酸锂和硫酸钠的混合溶液,蒸发浓缩后加入饱和碳酸钠溶液,趁热过滤得到碳酸锂沉淀;提纯后加入草酸和磷酸铁经煅烧得到LiFePO4。
(1)锂元素的焰色反应为紫色;铁元素无焰色反应,所以选A;
(2)根据分析可知,滤渣1主要为Al2O3·4SiO2·H2O;得到的红褐色沉淀应为Fe(OH)3,再结合![]() =3以及溶液中有过量的硫酸,所以离子方程式为Fe3++3H++3CaCO3= Fe(OH)3+3Ca2++3CO2↑,考虑到溶液中有大量硫酸根也可以写成Fe3++3H++3CaCO3+3SO42-= Fe(OH)3+3CaSO4+3CO2↑;根据分析可知滤渣2的主要成分是Fe(OH)3、Mg(OH)2以及CaSO4;摩尔质量为89 g·mol -1,则该物质的式量为89,Fe(OH)3的式量为107,107-89=18,说明脱水过程失去一分子水,所以新物质的化学式为:FeO(OH);
=3以及溶液中有过量的硫酸,所以离子方程式为Fe3++3H++3CaCO3= Fe(OH)3+3Ca2++3CO2↑,考虑到溶液中有大量硫酸根也可以写成Fe3++3H++3CaCO3+3SO42-= Fe(OH)3+3CaSO4+3CO2↑;根据分析可知滤渣2的主要成分是Fe(OH)3、Mg(OH)2以及CaSO4;摩尔质量为89 g·mol -1,则该物质的式量为89,Fe(OH)3的式量为107,107-89=18,说明脱水过程失去一分子水,所以新物质的化学式为:FeO(OH);
(3)碳酸锂在水中的溶解度随温度升高而减小,所以趁热过滤可以减小碳酸锂的溶解度,减少碳酸锂的损耗;
(4)煅烧制备过程的原料为Li2CO3、H2C2O4和FePO4,产物中有LiFePO4,铁元素的化合价降低,则该过程中某种物质被氧化,根据元素化合价变化规律可知草酸中的C元素被氧化,由+3价升高为+4价,结合电子守恒和元素守恒可知方程式为:Li2CO3+H2C2O4+2FePO4![]() 2LiFePO4+3CO2↑+H2O↑;
2LiFePO4+3CO2↑+H2O↑;
(5)放电时正极得电子发生还原反应,负极失电子被氧化,根据总反应可知负极应为CLix-xe-=xLi++C,正极反应等于总反应减去负极反应,所以正极反应为:即Li1-xFePO4+xLi++xe- =LiFePO4。

 名校课堂系列答案
名校课堂系列答案【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质结构 信息 | 核外电子共有7种运动状态 | 原子的M层有1对成对的p电子 | 一种核素的中子数为35、质量数为64 | 有多种同位素,其中一种用做测量相对原子质量的校准 |
(1)写出B原子的电子排布式___________。写出C原子的电子排布式___________
(2)四种元素中非金属性最强的元素是____,金属性最强的元素是_____,第一电离能最大的元素是______;
(3)一定条件下B、C单质间能反应,相应的反应方程式为__________________________。