题目内容
20.下列说法中,正确的是( )| A. | 双原子分子中的共价键,一定是非极性键 | |
| B. | 任何原子的原子核都是由质子和中子构成的 | |
| C. | 非极性键也可能存在于离子化合物中 | |
| D. | BF3和CS2分子中所有原子的最外层都是8电子稳定结构 |
分析 A.不同非金属性元素之间形成极性键;
B.${\;}_{1}^{1}$H中只有质子;
C.离子化合物中可能含有共价键;
D.原子的价电子数+化合价的绝对值=8,则该原子最外层为8电子稳定结构.
解答 解:A、双原子分子中的共价键也可能是极性键,如HF,故A错误.
B、${\;}_{1}^{1}$H中只有质子,中子数=质量数-质子数=1-1=0,没有中子,故B错误;
C.离子化合物中可能含有共价键,同种非金属元素形成的共价键属于非极性键,如Na2O2,故C正确;
D.BF3中B的价电子数为3,化合价为3,则最外层电子数6,不满足8电子稳定结构,CS2分子中所有原子的最外层都是8电子稳定结构,故D错误.
故选C.
点评 本题考查了化学键与物质的关系,要注意:双原子分子不仅可能是单质还可能是化合物,题目难度不大.

练习册系列答案
相关题目
10.某元素X的最高价氧化物的化学式为X2O5,则它的气态氢化物化学式为( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH5 |
11.下列哪组离子能在水溶液中大量共存( )
| A. | K+、CO32-、HS-、S2-、Al3+、AlO2- | B. | MnO4-、Na+、SO42-、K+、Cl- | ||
| C. | SO42-、Ag+、SO32-、S2-、AlO2-、K+ | D. | Fe3+、Cl-、H+、NO3- |
15.按Si、P、S、Cl的顺序递增排列的是( )
①气态氢化物的稳定性 ②最高化合价 ③第一电离能 ④电负性.
①气态氢化物的稳定性 ②最高化合价 ③第一电离能 ④电负性.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
5.已知反应A2(g)+B2(g)=2AB(g),断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2kJ,生成1molAB中的化学键释放的能量为Q3kJ(Q1、Q2、Q3均大于零),则下列说法正确的是( )
| A. | 若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 | |
| B. | 若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
10.在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
| A. | 金属元素 | B. | 非金属元素 | ||
| C. | 稀有气体元素 | D. | 无法确定为哪一类元素 |
 ;
;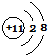 .D在周期表中位置第三周期第ⅥA族.
.D在周期表中位置第三周期第ⅥA族.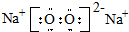 .
. 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;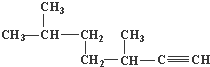 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔; ;
;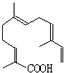 所示,分子式为C15H22O2;该物质可以与下列ABCD(填序号)发生反应.
所示,分子式为C15H22O2;该物质可以与下列ABCD(填序号)发生反应. 中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基. .
.