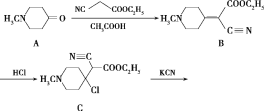
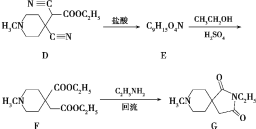
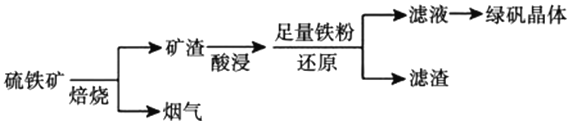
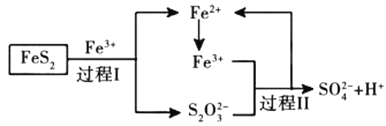
题目内容
【题目】常温下,下列说法不正确的是( )
A.0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中,Fe3+的浓度之比大于10
B.将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3·H2O的电离常数为![]()
C.pH加和为12的强酸与弱酸混合,pH可能为6
D.0.1mol·L-1 NH4HS溶液中有:c(NH4+)=c(HS-)+c(S2-)+c(H2S)
【答案】D
【解析】
A、FeCl3在水溶液中能发生水解Fe3+ +3H2O![]() Fe(OH)3+3H+,溶液越稀水解程度越大, Fe3+浓度越小,所以0.01mol/L FeCl3溶液中Fe3+浓度小于0.1mo/L FeCl3溶液中Fe3+浓度的
Fe(OH)3+3H+,溶液越稀水解程度越大, Fe3+浓度越小,所以0.01mol/L FeCl3溶液中Fe3+浓度小于0.1mo/L FeCl3溶液中Fe3+浓度的![]() ,故0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中, Fe3+的浓度之比大于10,选项A正确;
,故0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中, Fe3+的浓度之比大于10,选项A正确;
B、在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3H2O的电离常数Kb=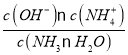 =
=![]() =
=![]() ,选项B正确;
,选项B正确;
C、pH加和为12的强酸与弱酸,因为酸的pH都小于7,则二者的pH在5-7之间,混合后pH可能为6,选项C正确;
D、0.1mol·L-1 NH4HS溶液中依据物料守恒有:c(NH3·H2O)+c(NH4+)=c(HS-)+c(S2-)+c(H2S),选项D不正确;
答案选D。

【题目】填表
微粒 | 核外电子数 | 中子数 | 质量数 | 最外层电子数 |
| __________ | ____________ | _________ | _________ |
| _________ | ___________ | _________ | ____________ |
| ___________ | ________ | ______ | ________ |