题目内容
【题目】以硫铁矿(主要成分为![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)为原料制备绿矾晶体
等杂质)为原料制备绿矾晶体![]() 的工艺流程如下:
的工艺流程如下:
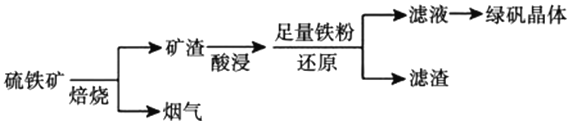
(1)“酸浸”过程,矿渣中的![]() 与稀
与稀![]() 反应的离子方程式____________________。
反应的离子方程式____________________。
(2)烟气中的![]() 会污染环境,可用足量氨水吸收。写出该反应的离子方程式____________________________。
会污染环境,可用足量氨水吸收。写出该反应的离子方程式____________________________。
(3)写出检验滤液中阴离子的方法___________________________。
(4)铁粉还原过滤,滤渣主要成分是___________________________(写化学式)。
(5)燃料细菌脱硫法是用氧化亚铁硫杄菌(T.f)对硫铁矿进行催化脱硫,同时得到![]() 溶液。其过程如图所示:
溶液。其过程如图所示:
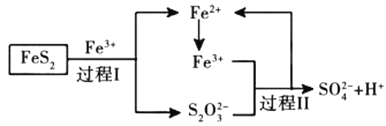
已知总反应为:![]()
写出过程Ⅱ反应的离子方程式________________________________。
【答案】![]()
![]() 取少量溶液于试管中,先加稀盐酸,再加
取少量溶液于试管中,先加稀盐酸,再加![]() 溶液,有白色沉淀生成,证明含有硫酸根离子
溶液,有白色沉淀生成,证明含有硫酸根离子 ![]() 、
、![]() 、
、![]()
![]()
【解析】
根据物质的性质分析书写反应方程式;根据常见离子的检验方法分析解答;根据题给信息中反应物和生成物根据氧化还原反应原理书写相关反应方程式。
(1)矿渣中的Fe2O3与稀H2SO4反应生成硫酸铁和水,离子方程式![]() ;故答案为:
;故答案为:![]() ;
;
(2)烟气中的SO2会污染环境,可用足量氨水吸收,二氧化硫和氨水反应生成亚硫酸铵和水,反应方程式为:![]() ;故答案为:
;故答案为:![]() ;
;
(3)滤液中阴离子为硫酸根离子,检验方法为:取少量溶液于试管中,先加稀盐酸,再加![]() 溶液,有白色沉淀生成,证明含有硫酸根离子,故答案为:取少量溶液于试管中,先加稀盐酸,再加
溶液,有白色沉淀生成,证明含有硫酸根离子,故答案为:取少量溶液于试管中,先加稀盐酸,再加![]() 溶液,有白色沉淀生成,证明含有硫酸根离子;
溶液,有白色沉淀生成,证明含有硫酸根离子;
(4)加入过量铁粉,则Cu2+被还原生成单质Cu, ![]() 不与酸反应,所以滤渣为
不与酸反应,所以滤渣为![]() 、
、![]() 、
、![]() ,故答案为:
,故答案为:![]() 、
、![]() 、
、![]() ;
;
(5)根据题给信息知,过程Ⅱ的反应为Fe3+与S2O32反应生成SO42和氢离子、Fe2+,根据原子守恒分析反应物中有水参加,根据电子转移守恒及电荷守恒配平得反应为:![]() ;故答案为:
;故答案为:![]() 。
。