��Ŀ����
����Ŀ���������ʯ�е�һ�֣�����Ҫ�ɷ�Ϊ��������NaAl(Si2O6)��������Cr��Ni��Mn��Mg��Fe��Ԫ�ء��ش��������⣺
(1)Cr3+�����Ų�ʽΪ______________________����̬Siԭ���У�����ռ�ݵ�����ܲ����Ϊ______________________��
(2)�������Ҫ�ɷ�Ϊ�������ƣ�����Ԫ�صĵ�һ�������ɴ�С��˳��___________��
(3)�̵�һ�ֻ�����Ļ�ѧʽΪMn(BH4)2(THF)3��THT�Ľṹ��ʽ��ͼ��ʾ��
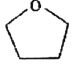
��THF��Cԭ�ӵ��ӻ��������Ϊ___________����BH4���Ŀռ乹��Ϊ___________
��NaBH4������ѧ��������_____________
A�����Ӽ� B�����ۼ� C����� D����λ��
(4)MnO���۵�(1660��)��MnS���۵�(1610��)�ߣ�ԭ��______________________��
(5)Ni�����γɶ������������һ��NixO����ľ����ṹΪNaCl�ͣ����ھ���ȱ�ݣ�xΪ0.88���Ҿ�����Ni�Ĵ�����ʽΪNi2+��Ni3+��������N i2+��Ni3+���������Ϊ___________���þ���ľ�������Ϊ428pm�������ܶ�Ϊ___________g��cm��3(NA��ʾ�����ӵ�������ֵ���г�����ʽ����)
���𰸡�[Ar]3d3 M O>Si>Al>Na sp3 �������� ABD ��Ϊ���Ӿ��壬O2-�뾶С��S2-�뾶��MnO�ľ����ܴ���MnS(�� MnO�����Ӽ�ǿ��MnS 8��3 4��(0.88��59+16)/NA(428��10-10)3[��4��67.92/NA(428��10-10)3��271.68/NA(428��10-10)3��3.46��1024/NA]
��������
��1��Crԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d54s1��ʧȥ4s�ܼ�1�����ӡ�3d�ܼ�2�������γ�Cr3+����Siԭ�Ӻ��������Ϊ14����̬ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p2��
��2���ǽ�����Խǿ����һ������Խ��
��3�������ӻ�������۽����жϣ�
��4������Ϊ���Ӿ��壬O2-�뾶С��S2-�뾶��MnO�ľ����ܴ���MnS(��MnO�����Ӽ�ǿ��MnS��
��5�������ܶ�=����/������м��㡣
��1��Crԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d54s1��ʧȥ4s�ܼ�1�����ӡ�3d�ܼ�2�������γ�Cr3+����̬Cr3+�ĺ�������Ų�ʽΪ[Ar]3d3��Siԭ�Ӻ��������Ϊ14����̬ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p2������ռ�ݵ�����ܲ����ΪM���ʴ�Ϊ��[Ar]3d3��M��
��2������������O��Na��Al��Si����Ԫ�ع��ɣ��ǽ�����Խǿ����һ������Խ�����Ե�����Ԫ�صĵ�һ�������ɴ�С��˳��ΪO>Si>Al>Na���ʴ�Ϊ��O>Si>Al>Na��
��3���ٸ���THF�Ľṹʽ��֪��Cԭ�ӵ��ӻ��������Ϊsp3�ӻ����ʴ�Ϊ��sp3��
��BH4-��Bԭ�Ӽ۲������=4+1/2����3+1-4��1��=4���Ҳ����µ��Ӷԣ������ӻ�������ۣ�BH4-��Bԭ�ӵ��ӻ�����Ϊsp3�ӻ������Կռ乹�����������幹�ͣ�
�ʴ�Ϊ���������塣
��Na+��BH-4֮��������Ӽ�����ԭ�Ӻ���ԭ��֮����ڹ��ۼ�����λ�������Ըû������в����������NaBH4������ѧ�����������Ӽ������ۼ�����λ�����ʴ�Ϊ��ABD��
��4��MnO���۵㣨1650�棩��MnS���۵㣨1610�棩�ߣ������۵�ϸߣ�ӦΪ���Ӿ��壬O2-�뾶С��S2-�뾶��MnO�ľ����ܴ���MnS�����Ӿ��徧����Խ���۵�Խ�ߣ���MnO���۵�ϸߣ��ʴ�Ϊ����Ϊ���Ӿ��壬O2-�뾶С��S2-�뾶��MnO�ľ����ܴ���MnS(��MnO�����Ӽ�ǿ��MnS��
��5��xΪ0.88���辧����Ni3+����Ϊx��Ni2+����Ϊy����x+y=0.88��3x+2y-2=0����ʽΪ���ϼ�������Ϊ�㣩���ɽ�ã�x=0.24��y=0.64��������Ni2+��Ni3+���������Ϊ0.64��0.24=8��3��ȡ1mol����������NA��������NixO����ľ����ṹΪNaCl�ͣ���һ�������У�Niԭ����ĿΪ8��1/8+6��1/2=4��Oԭ����ĿΪ12��1/4+1=4����1mol����������Ϊm=4��(0.88��59+16)g��һ�����������ΪV=4283pm3=(428��10-10)3cm3��������ܶ�Ϊ��=m/NAV=4��(0.88��59+10)/NA(428��10-10)3g��cm��3��
�ʴ�Ϊ��8��3��4��(0.88��59+16)/NA(428��10-10)3[��4��67.92/NA(428��10-10)3��271.68/NA(428��10-10)3��3.46��1024/NA]��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ʵʩ�Խ�Լ��Դ�ͼ��ٷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ���ش��������⣺
��1����֪ij�¶���ij��Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ��K=c(H2O)/[ c(CO)��c(H2)]����Ӧ�Ļ�ѧ��Ӧ����ʽΪ��________��
��2����֪��һ���¶��£�
��C(s)+CO2(g) ![]() 2CO(g) ��H1=a kJ/mol ƽ�ⳣ��K1��
2CO(g) ��H1=a kJ/mol ƽ�ⳣ��K1��
��CO(g)+H2O(g) ![]() H2(g)+CO2(g) ��H2=b kJ/mol ƽ�ⳣ��K2��
H2(g)+CO2(g) ��H2=b kJ/mol ƽ�ⳣ��K2��
��C(s)+H2O(g) ![]() CO(g)+H2(g)��H3 ƽ�ⳣ��K3��
CO(g)+H2(g)��H3 ƽ�ⳣ��K3��
��K1��K2��K3֮��Ĺ�ϵ�ǣ�________����H3=________���ú�a��b�Ĵ���ʽ��ʾ����
��3��ú����ͨ��ͨ���о���ͬ�¶���ƽ�ⳣ���Խ������ʵ�����⡣��֪�������һ����̼��ˮ�������뷴Ӧ��ʱ���������·�Ӧ��CO(g)+H2O(g) ![]() H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���±���ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�÷�Ӧ������Ӧ������________��Ӧ������ȡ����ȡ���������500��ʱ���У�����ʼʱCO��H2O����ʼŨ�Ⱦ�Ϊ0.020 mol/L���ڸ������£�CO��ƽ��ת����Ϊ��________��