��Ŀ����
����Ŀ������ӵ���봫ͳ�����ȣ������죬�����ܶȸ��ߣ�ʹ��ʱ����������ֻ��ͱʼDZ����Եȱ�Яʽ���Ӳ�Ʒ�Ϲ㷺Ӧ�á���ҵ�ϳ���﮻Կ�(��Ҫ�ɷ�Ϊ LiAlSi2O6��������FeO��MgO��CaO������)Ϊԭ������ȡ����ﮣ�����һ�ֹ�����������

��֪
�ٲ��ֽ����������↑ʼ��������ȫ����ʱ��pH��

��Li2CO3���ܽ�����¶ȱ仯��ͼ��ʾ��
�Իش��������⣺
(1)���ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�����¶ȡ������ʯ�����衢���˺��ٴν�ȡ�ȴ�ʩ����ͨ��_______����߽�ȡ�ʡ�
(2)��ӦI��Ӧ����pH��ΧΪ_______������A�ijɷֳ�H2SiO3��CaCO3��Al(OH)3�⣬����___________��
(3)��Ӧ������ӷ���ʽΪ_________________��
(4)������I��������Ϊ______��ϴ��Li2CO3����Ҫʹ��___(ѡ������ˮ��������ˮ��)��������_________��
(5)��֪�(Rb)��������ܵIJ��ϣ������ͬ���塣�� amol CH3 COORb����ˮ�����Һ�������Һ�еμ� bLc mol��L�������Һ�����ԡ���c=_______(�ú�a��b��ʽ�ӱ�ʾ����֪25��ʱ��CH3COOH����ƽ�ⳣ��ka��2![]() 10��5)��
10��5)��
���𰸡��ӳ���ȡʱ�䣨���������Ũ�ȣ� 4.7~9.6 Fe(OH)3��CaSO4 Mg2����2OH����Mg(OH)2�� (��Mg2����Ca(OH)2��Ca2+��Mg(OH)2��) Ca2+��CO32-= CaCO3�� ���� ��ˮ ̼��﮵��ܽ�����¶����߶����ͣ���ˮϴ�ӿ��Լ���̼��﮵��ܽ���ʧ ![]()
��������
��1����߽�ȡ�ʣ����������Ũ�ȡ������¶ȡ��������������������ӳ���ȡʱ��ȣ�
(2)��ӦI�е���pH��Ŀ���dz�ȥMg2+��Al3+��
(3)��Ӧ�����pH=11��Ŀ���dz�ȥMg2����
(4)������I��Ŀ���Ƿ��������̼��ﮣ�����̼��﮵��ܽ�����¶����߶����ͷ�����
(5)����![]() ��������Ũ�ȡ�
��������Ũ�ȡ�
��1���������Ũ�ȡ������¶ȡ��������������������ӳ���ȡʱ�������߽�ȡ�ʣ�����Ϊ����߽�ȡ�ʿɲ�ȡ�����¶ȡ������ʯ�����衢���˺��ٴν�ȡ�ȴ�ʩ����ͨ���ӳ���ȡʱ����������Ũ������߽�ȡ�ʣ�
(2)��ӦI�е���pH��Ŀ���dz�ȥFe3+��Al3+�����Ե���pH��ΧΪ4.7��9.6�����������ˮ�����Գ���A�ijɷֳ�H2SiO3��CaCO3��Al(OH)3�⣬����Fe(OH)3��CaSO4��
(3)��Ӧ�����pH=11��Ŀ���dz�ȥMg2������Ӧ����Ҫ���ӷ���ʽ��Mg2����2OH����Mg(OH)2����
(4)������I��Ŀ���Ƿ��������̼��ﮣ����ԡ�����I���ǹ��ˣ�̼��﮵��ܽ�����¶����߶����ͣ���ˮϴ�ӿ��Լ���̼��﮵��ܽ���ʧ������ϴ��Li2CO3����Ҫʹ����ˮ��
(5) �� amol CH3 COORb����ˮ�����Һ�������Һ�еμ� bLc mol��L�������Һ�����ԡ����Ϻ���Һ�����ΪV�����������غ㣬c(CH3COOH)��c(CH3COO��)��(a+bc)/V�����ݵ���غ㣬c(CH3COO��) �� c(Rb+)��a/V������c(CH3COOH)��bc/V��![]() ��
��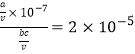 ������c=
������c=![]() ��
��






