题目内容
9.化学反应的实质是旧化学键的断裂与新化学键的生成.从能量的角度看,断开化学键要吸收能量,形成化学键要放出能量.化学反应是释放能量还是吸收能量取决于反应物和生成物能量的相对大小,当反应物的总能量高于生成物时,该反应为放热反应;当反应物的总能量低于生成物时,该反应为吸热反应.分析 根据断开化学键要吸收能量,形成化学键要放出能量;根据化学发应中能量变化的宏观表现.
解答 解:化学反应的实质是旧化学键的断裂与新化学键的生成,因断开化学键要吸收能量,形成化学键要放出能量,因化学发应中能量变化的宏观表现是反应物总能量和生成物总能量不相等,若为放热反应,反应物总能量高于生成物总能量,若为吸热反应,应物总能量低于生成物总能量,
故答案为:旧化学键的断裂与新化学键的生成;吸收能量;放出能量;反应物和生成物能量的相对大小;放热;吸热.
点评 本题主要考查了化学键的断开与形成与能量的关系、化学发应中能量变化的宏观表现,难度不大,根据课本知识即可完成.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
19.下列属于化学变化的且生成物总能量比反应物总能量高的是( )
①液态水汽化;②N2与氧气反应生成NO;③NH4Cl与Ba(OH)2.8H2O反应;④氯酸钾分解制氧气;⑤H2与氧气反应生成H2O.
①液态水汽化;②N2与氧气反应生成NO;③NH4Cl与Ba(OH)2.8H2O反应;④氯酸钾分解制氧气;⑤H2与氧气反应生成H2O.
| A. | ①③④ | B. | ②③④ | C. | ②③ | D. | ③④ |
20.分别将1g Na2CO3和1g NaHCO3装在两支试管中,各加入10mL水,振荡使它们溶解,冷却到室温后,分别向两支试管中滴入2滴酚酞.下列说法正确的是( )
| A. | 两支试管中的溶液都显红色,且Na2CO3溶液比NaHCO3溶液更红 | |
| B. | 两支试管中的溶液都显红色,且两者颜色没有区别 | |
| C. | 两支试管中的溶液都显蓝色,且Na2CO3溶液比NaHCO3溶液更蓝 | |
| D. | 两支试管中的溶液都不显颜色 |
17.下列物质中,分子的一端亲水,分子的另一端亲油的是( )
| A. | CH3Cl | B. | 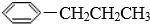 | C. | CH3(CH2)4COOCH3 | D. | CH3(CH2)13SO3Na |
14.下列有关胶体的叙述中不正确的是( )
| A. | 淀粉溶胶中胶体微粒直径大小在1~100nm | |
| B. | 用一束光照射氢氧化铁胶体,可以观察到一条光亮的通路 | |
| C. | 向烧杯中沸腾的蒸馏水里加几滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热可得氢氧化铁胶体 | |
| D. | 可以利用过滤操作来分离胶体粒子和溶液 |
1.设NA表示阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 标准状况下,2.24L甲醇中含有的原子总数为0.6NA | |
| B. | 室温下,500mL pH=1的稀硫酸中含有的H+总数约为0.05NA | |
| C. | 7.8g Na2O2晶体中含有的离子总数为0.4NA | |
| D. | 电解精炼铜时,若阴极得到电子总数为2NA,则阳极质量减少64g |
18.下列各组离子能大量共存的是( )
| A. | Ba2+、Fe3+、OH-、Cl- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | NH4+、Ba2+、NO3-、OH- | D. | H+、K+、NO3-、CO32- |
19.下列对乙烯分子的叙述中错误的是( )
| A. | 乙烯分子里所有的原子在同一平面上 | |
| B. | 乙烯的结构简式为CH2CH2,电子式为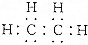 | |
| C. | 乙烯分子中碳氢键之间的夹角约为120° | |
| D. | 乙烯分子中既含有极性键又含有非极性键 |
