题目内容
t℃时,水的离子积为KW,该温度下将a mol?L-1一元酸HA与b mol?L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是( )
| A、混合液的pH=7 | ||
B、混合液中c(H+)=
| ||
| C、a=b | ||
| D、混合液中c(B+)=c(A-)+c(OH-) |
考点:离子积常数
专题:电离平衡与溶液的pH专题
分析:Kw=c(H+)?c(OH-),该温度下将amol/L一元酸HA与bmol/L一元碱BOH等体积混合,若混合后溶液呈中性,则c(H+)=c(OH-),温度不确定,则中性时溶液pH不一定为7,由于酸碱的强弱未知,则不能确定a、b的关系.
解答:
解:A.温度不确定,则中性时溶液pH不一定为7,故A错误;
B.Kw=c(H+)?c(OH-),混合后溶液呈中性,则c(H+)=c(OH-),c(H+)=
,故B正确;
C.由于酸碱的强弱未知,则不能确定a、b的关系,故C错误;
D.根据电荷守恒可知:c(B+)+c(H+)=c(A-)+c(OH-),c(H+)=c(OH-),故c(B+)=c(A-),故D错误,
故选B.
B.Kw=c(H+)?c(OH-),混合后溶液呈中性,则c(H+)=c(OH-),c(H+)=
| KW |
C.由于酸碱的强弱未知,则不能确定a、b的关系,故C错误;
D.根据电荷守恒可知:c(B+)+c(H+)=c(A-)+c(OH-),c(H+)=c(OH-),故c(B+)=c(A-),故D错误,
故选B.
点评:本题考查酸碱混合的定性判断和离子浓度大小比较问题,难度中等,注意题中温度、酸碱的强弱等问题.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列化学(或离子)方程式中,不正确的是( )
A、为减少煤燃烧产生SO2,用CaCO3脱硫:2CaCO3+O2+2SO2
| ||||
| B、碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-═NH3?H2O | ||||
| C、从酸化的海带灰浸出液中提取碘:2I-+2H++H2O2═I2+2H2O | ||||
D、将Na2CO3加热至熔融不能选用石英坩埚:SiO2+Na2CO3
|
如图是某盐酸试剂标签部分内容,据此判断( )


| A、该盐酸与钠可存放在同一药品橱柜中 |
| B、该盐酸含HCl质量为600g |
| C、配制100mL 0.2mol/L盐酸需用到玻璃仪器为量简、烧杯、玻璃棒 |
| D、该盐酸的物质的量浓度为12.0mol/L |
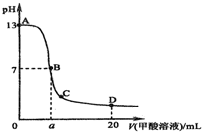 在15mL 0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线.下面有关微粒浓度的大小关系正确的是( )
在15mL 0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线.下面有关微粒浓度的大小关系正确的是( )| A、在A、B间的任意一点上都存在:c(K+)>c(HCOO-)>c(OH-)>c(H+) |
| B、在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 |
| C、在C点:c(HCOO-)>c(K+)>c(H+)>c(OH-) |
| D、在D点:c(HCOO-)+c(HCOOH)>2c(K+) |
下列物质中,不属于合金的是( )
| A、硬铝 | B、水银 | C、钢铁 | D、黄铜 |
把过量的CO2分别通入下列溶液:①Ca(NO3)2溶液 ②溶有氨的CaCl2溶液 ③苯酚钠的稀溶液 ④溶有大量氨的饱和食盐水,最终能看到白色沉淀的有( )
| A、只有④ | B、②④ |
| C、②③④ | D、①②③④ |
“可燃冰”是水与天然气相互作用形成的晶体物质,经研究测定:每立方米“可燃冰”可释放出200m3的甲烷气体.下列说法不正确的是( )
| A、“可燃冰”将有可能成为新能源 |
| B、“可燃冰”实质是水变成的固态油 |
| C、“可燃冰”使用方便,清洁卫生 |
| D、在海底和冻土层可能存在“可燃冰” |
已知反应KClO3+6HCl═KCl+3Cl2↑+3H2O.下列判断正确的是( )
| A、KClO3被氧化 |
| B、氧化剂与还原剂之比为1:6 |
| C、氧化产物是Cl2 |
| D、HCl在化学反应中只能作还原剂 |