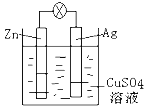
题目内容
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | |||
三 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
四 | ||||||||
(1)写出下列元素符号;②_______、_______;表中在室温下呈液态的单质,其化学式为________.
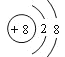
(2)表中元素⑦的原子结构示意图为____________;元素⑤的离子结构示意图为_________;元素与元素两者核电荷数之差是_______
(3)分别写出元素⑨的最高价氧化物的水化物与元素⑦、的最高价氧化物的水化物反应的化学方程式_________________________________;________________________.
(4)分别写出③与、与⑥组成的化合物的电子式__________;_________
(5)用电子式表示①与⑩组成的化合物的形成过程______________________
(6)表中元素⑩和最高价氧化物对应水化物的酸性:______>_____(写化学式)。
【答案】Li O Br2 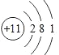
 18 Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+3HClO4=Al(ClO4)3+3H2O
18 Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+3HClO4=Al(ClO4)3+3H2O 
![]()
![]() HClO4 H2SO4
HClO4 H2SO4
【解析】
由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为Al、⑩为S、为Cl、为Ar、为K、为Ca、为Br、为Kr;再结合元素周期律解题。
由元素在周期表中位置,可知①为H、②为Li、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为Al、⑩为S、为Cl、为Ar、为K、为Ca、为Br、为Kr;
(1)由分析可知②锂元素,元素符号为Li;为氧元素,元素符号为O;溴为唯一的液态非金属单质,其化学式为Br2;
(2)元素⑦为Na,其原子结构示意图为 ;元素⑤为O,O2-的离子结构示意图为
;元素⑤为O,O2-的离子结构示意图为 ;元素为Ar,核电荷数为18,元素为氪,核电荷数为36,两者核电荷数之差是18;
;元素为Ar,核电荷数为18,元素为氪,核电荷数为36,两者核电荷数之差是18;
(3)元素⑨为Al,其最高价氧化物的水化物是Al(OH)3;元素⑦为Na,其最高价氧化物的水化物为NaOH;为Cl,其最高价氧化物的水化物为HClO4,Al(OH)3分别与NaOH、HClO4反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O、Al(OH)3+3HClO4=Al(ClO4)3+3H2O;
(4)③为C、为Cl,两者组成的化合物为CCl4,共价化合物,则CCl4的电子式为![]() ;为Ca、⑥为F,两者组成的化合物为CaF2,为离子化合物,则CaF2的电子式为
;为Ca、⑥为F,两者组成的化合物为CaF2,为离子化合物,则CaF2的电子式为![]() ;
;
(5)①为H、⑩为S,两者组成的化合物为H2S,H2S为共价化合物,则其电子式的形成过程为![]() ;
;
(6)元素⑩为S、为Cl,非金属性Cl>S,则最高价氧化物对应水化物的酸性HClO4>H2SO4。

【题目】下列方法中,不能用于实验室制取氨的是
A. 在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
B. 加热试管中的氯化铵固体
C. 将烧瓶中的浓氨水加热
D. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
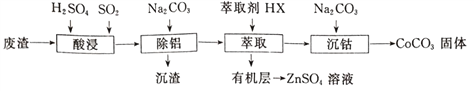
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________。
(2)“除铝”过程中需要调节溶液pH的范围为______________,形成沉渣时发生反应的离子方程式为_____________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为____________________。