题目内容
短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数.D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是 (填元素符号或化学式,下同);第一电离能从大到小的顺序是
(2)C原子的电子排布图 ,D2-的结构示意图 .A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式 ,分子中含有 键(填“极性”或“非极性”,下同)是 分子.
(3)A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式 ,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为 杂化,空间构型为 .
(4)C和E形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质.则Y的化学式为 ,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为 .
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是
(2)C原子的电子排布图
(3)A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式
(4)C和E形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质.则Y的化学式为
分析:短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,则A处于第一周期,B、C处于第二周期,A原子的最外层电子数等于其电子层数,则A为氢元素;C原子的价电子构型为nsnnpn+1,s能级只能容纳2个电子,即n=2,C原子的价电子构型为2s22p3,故C为氮元素;C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,则B原子最外层电子数为5-1=4,则B为碳元素;D原子的2p能级上有两个未成对电子,原子序数大于氮元素,则D原子的价电子构型为2s22p4,故D为氧元素;D和E可以形成原子个数比为1:1和1:2的两种离子化合物,则E为Na元素,据此解答.
解答:解:短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,则A处于第一周期,B、C处于第二周期,A原子的最外层电子数等于其电子层数,则A为氢元素;C原子的价电子构型为nsnnpn+1,s能级只能容纳2个电子,即n=2,C原子的价电子构型为2s22p3,故C为氮元素;C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,则B原子最外层电子数为5-1=4,则B为碳元素;D原子的2p能级上有两个未成对电子,原子序数大于氮元素,则D原子的价电子构型为2s22p4,故D为氧元素;D和E可以形成原子个数比为1:1和1:2的两种离子化合物,则E为Na元素,
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>C>N>O;
自左而右第一电离能呈增大趋势,氮元素原子2p能级容纳3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能从大到小的顺序是N>O>C>Na,
故答案为:Na>C>N>O;N>O>C>Na;
(2)C为氮元素,N原子的电子排布图为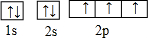 ,O2-的结构示意图为
,O2-的结构示意图为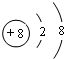 .H、O可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,该化合物为H2O2,该化合物的结构式H-O-O-H,分子中氧原子与氢原子之间为极性键、氧原子之间为非极性键,为展开书页型结构,是极性分子,
.H、O可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,该化合物为H2O2,该化合物的结构式H-O-O-H,分子中氧原子与氢原子之间为极性键、氧原子之间为非极性键,为展开书页型结构,是极性分子,
故答案为: ;
;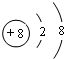 ;H-O-O-H;极性、非极性;极性;
;H-O-O-H;极性、非极性;极性;
(3)H、C、O三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物为HCHO.其电子式为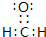 ,根据价层电子对互斥(VSEPR)理论,该分子中心原子C原子价层电子对水为3,不含孤电子对,故C原子的杂化方式为sp2杂化,空间构型为平面三角形,
,根据价层电子对互斥(VSEPR)理论,该分子中心原子C原子价层电子对水为3,不含孤电子对,故C原子的杂化方式为sp2杂化,空间构型为平面三角形,
故答案为: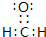 ;sp2;平面三角形;
;sp2;平面三角形;
(4)Na和N形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质,分解为Na与氮气,Y的阴离子是一种弱酸根离子,全由C元素组成,令组成为NaxNy,则23x+14y=65,则x=1,y=3,故则Y为NaN3,与盐酸反应的离子方程式为N3-+3H+=NH3↑,
故答案为:NaN3;N3-+3H+=NH3↑.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>C>N>O;
自左而右第一电离能呈增大趋势,氮元素原子2p能级容纳3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能从大到小的顺序是N>O>C>Na,
故答案为:Na>C>N>O;N>O>C>Na;
(2)C为氮元素,N原子的电子排布图为
 ,O2-的结构示意图为
,O2-的结构示意图为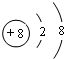 .H、O可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,该化合物为H2O2,该化合物的结构式H-O-O-H,分子中氧原子与氢原子之间为极性键、氧原子之间为非极性键,为展开书页型结构,是极性分子,
.H、O可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,该化合物为H2O2,该化合物的结构式H-O-O-H,分子中氧原子与氢原子之间为极性键、氧原子之间为非极性键,为展开书页型结构,是极性分子,故答案为:
 ;
;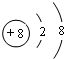 ;H-O-O-H;极性、非极性;极性;
;H-O-O-H;极性、非极性;极性;(3)H、C、O三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物为HCHO.其电子式为
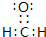 ,根据价层电子对互斥(VSEPR)理论,该分子中心原子C原子价层电子对水为3,不含孤电子对,故C原子的杂化方式为sp2杂化,空间构型为平面三角形,
,根据价层电子对互斥(VSEPR)理论,该分子中心原子C原子价层电子对水为3,不含孤电子对,故C原子的杂化方式为sp2杂化,空间构型为平面三角形,故答案为:
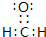 ;sp2;平面三角形;
;sp2;平面三角形;(4)Na和N形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质,分解为Na与氮气,Y的阴离子是一种弱酸根离子,全由C元素组成,令组成为NaxNy,则23x+14y=65,则x=1,y=3,故则Y为NaN3,与盐酸反应的离子方程式为N3-+3H+=NH3↑,
故答案为:NaN3;N3-+3H+=NH3↑.
点评:本题考查结构性质位置关系,侧重对常用化学用语的考查,难度中等,(4)为易错点,要求学生对生活知识的细心.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题: 学式,下同);第一电离能从大到小的顺序是
学式,下同);第一电离能从大到小的顺序是  _____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
_____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。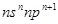 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题: