题目内容
短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数.D和E可以形成原子个数比为1∶1和1∶2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,半径从大到小的顺序是________(填元素符号或化学式,下同);第一电离能从大到小的顺序是________
(2)C原子的电子排布图________,D2-的结构示意图________.A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________,分子中含有________键(填“极性”或“非极性”,下同)是________分子.
(3)A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式________,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为________杂化,空间构型为________.
(4)C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质.则Y的化学式为________,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为________.
答案:
解析:
解析:
|
(1)Na>C>N>O;N>O>C>Na (2)略,H-O-O-H,极性键和非极性键,极性 (3)略;SP2;平面三角形 (4) |

练习册系列答案
相关题目
 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题: 学式,下同);第一电离能从大到小的顺序是
学式,下同);第一电离能从大到小的顺序是  _____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。
_____________,D2-的结构示意图___________。A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式________________,分子中含有_____________________键(填“极性”或“非极性”,下同)是__________分子。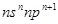 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题: