题目内容
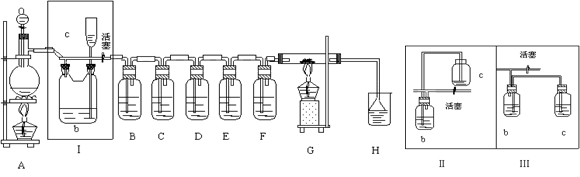
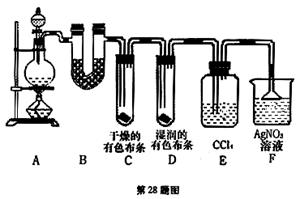
(16分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。(B中装的是无水硫酸铜)
(1)装置A的作用是制取氯气,其反应的化学方程式为:
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
(3)①装置B的作用是 ,现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是 。
④写出装置F中发生反应的离子方程式 。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号),装置中应放入 试剂。

(1)装置A的作用是制取氯气,其反应的化学方程式为:
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
(3)①装置B的作用是 ,现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是 。
④写出装置F中发生反应的离子方程式 。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 与 之间(填装置字母序号),装置中应放入 试剂。
(1)MnO2+4HCl MnCl2+Cl2↑+H2O(2分)
MnCl2+Cl2↑+H2O(2分)
(2)浓盐酸的浓度随着反应的进行变稀以后,将不再反应;加热时浓盐酸因挥发而损失(2分)
(3)①证明有水蒸气产生 白色变蓝色(其它合理答案也给分)(2分)②氯气无漂白性,氯
水有漂白性(2分) ③吸收氯气(2分) ④Ag-+Cl-=AgCl↓(2分)
(4)E F (2分) 湿润的淀粉KI试纸(或湿润的有色布条)(2分)
 MnCl2+Cl2↑+H2O(2分)
MnCl2+Cl2↑+H2O(2分)(2)浓盐酸的浓度随着反应的进行变稀以后,将不再反应;加热时浓盐酸因挥发而损失(2分)
(3)①证明有水蒸气产生 白色变蓝色(其它合理答案也给分)(2分)②氯气无漂白性,氯
水有漂白性(2分) ③吸收氯气(2分) ④Ag-+Cl-=AgCl↓(2分)
(4)E F (2分) 湿润的淀粉KI试纸(或湿润的有色布条)(2分)
本题以氯气为载体,综合考查常见的基本实验操作、氯气的性质检验以及尾气处理等
(1)实验室制取氯气一般用二氧化锰氧化浓盐酸生成,方程式为MnO2+4HCl MnCl2+Cl2↑+H2O。
MnCl2+Cl2↑+H2O。
(2)随着反应的进行盐酸的浓度会逐渐降低,而二氧化锰是不能氧化稀盐酸的,所以实际生成的氯气总是小于理论值。
(3)①无水硫酸铜常用来检验水的存在,因为硫酸铜吸水即变成蓝色的胆矾。
②氯气的漂白是靠次氯酸实现的,所以氯气不能使干燥的有色布条褪色。这说明氯气是没有漂白性的,次氯酸才具有漂白性。
③由于F是用来检验氯化氢的,而氯气也能和硝酸银反应产生白色沉淀,所以在通入硝酸银溶液之前要先除去氯气。利用氯气能溶解的有机溶剂中,除去氯气。
④氯化氢溶于水和硝酸银反应生成氯化银白色沉淀,方程式为Ag-+Cl-=AgCl↓。
(4)氯气受热能溶解在四氯化碳中,但无法确定是否完全被吸收。所以需要在E和F之间连接1个装置,用来检验氯气是否完全被除去。可利用氯气的氧化性,能把碘化钾氧化生成单质碘,而单质碘能和淀粉发生显色反应,使溶液显蓝色。所以试剂是湿润的淀粉KI试纸。也可以通过漂白性来检验,因此也可以选择湿润的有色布条。
(1)实验室制取氯气一般用二氧化锰氧化浓盐酸生成,方程式为MnO2+4HCl
 MnCl2+Cl2↑+H2O。
MnCl2+Cl2↑+H2O。(2)随着反应的进行盐酸的浓度会逐渐降低,而二氧化锰是不能氧化稀盐酸的,所以实际生成的氯气总是小于理论值。
(3)①无水硫酸铜常用来检验水的存在,因为硫酸铜吸水即变成蓝色的胆矾。
②氯气的漂白是靠次氯酸实现的,所以氯气不能使干燥的有色布条褪色。这说明氯气是没有漂白性的,次氯酸才具有漂白性。
③由于F是用来检验氯化氢的,而氯气也能和硝酸银反应产生白色沉淀,所以在通入硝酸银溶液之前要先除去氯气。利用氯气能溶解的有机溶剂中,除去氯气。
④氯化氢溶于水和硝酸银反应生成氯化银白色沉淀,方程式为Ag-+Cl-=AgCl↓。
(4)氯气受热能溶解在四氯化碳中,但无法确定是否完全被吸收。所以需要在E和F之间连接1个装置,用来检验氯气是否完全被除去。可利用氯气的氧化性,能把碘化钾氧化生成单质碘,而单质碘能和淀粉发生显色反应,使溶液显蓝色。所以试剂是湿润的淀粉KI试纸。也可以通过漂白性来检验,因此也可以选择湿润的有色布条。

练习册系列答案
相关题目