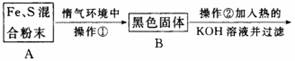
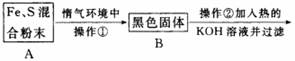
题目内容
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
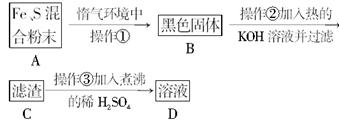
请完成以下问题:
(1)混合粉末A中硫粉过量的原因是__________________。
(2)反应在“惰气环境”中进行的原因是__________________。
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明__________________。
(4)操作②的作用是,反应方程式是__________________,也可改用加入__________________。
(5)操作③稀H2SO4煮沸的目的是__________________。
(6)为证明产物中铁的价态,对D溶液的实验操作最好是__________________。
(1)防止因铁粉过量而使滤渣C中的铁粉与H2SO4反应,生成Fe2+干扰实验
(2)防止环境中的O2参与反应
(3)硫和铁粉反应是放热的
(4)除去混合物中的硫粉
3S+6KOH![]() 2K2S+K2SO3+3H2OCS2
2K2S+K2SO3+3H2OCS2
(5)防止H2SO4溶解的氧气氧化生成的Fe2+
(6)加入煮沸的KSCN溶液,看是否变为血红色溶液
解析:
铁元素有可变价态。铁遇强氧化剂,如O2、Cl2之类,会被氧化成+3价;遇弱氧化剂,会被氧化到+2价。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目