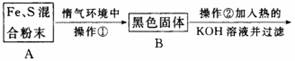
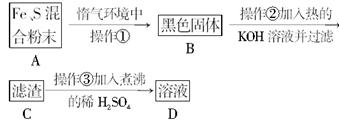
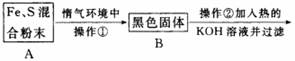
题目内容
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
请完成以下问题:
(1)混合粉末A中硫粉过量的原因是_____________________________________________。
(2)反应在“惰气环境”中进行的原因是__________________________________________。
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明_________________。
(4)操作②的作用是_____________________,反应方程式是__________________________,也可改用加入________________。
(5)操作③稀H2SO4煮沸的目的是___________________________________________。
(6)为证明产物中铁的价态,对D溶液的实验操作最好是____________________________。
解析:只要搞清设计实验的目的和原理,结合硫和铁反应的特点,注意空气的氧化性,问题即可迎刃而解。
答案:(1)防止因铁粉过量而使滤渣C中的铁粉与H2SO4反应,生成Fe2+干扰实验
(2)防止环境中的O2参与反应
(3)硫和铁粉反应是放热的
(4)除去混合物中的硫粉
3S+6KOH![]() 2K2S+K2SO3+3H2O CS2
2K2S+K2SO3+3H2O CS2
(5)防止H2SO4溶解的氧气氧化生成的Fe2+
(6)加入煮沸的KSCN溶液,看是否变为血红色溶液

练习册系列答案
相关题目