题目内容
(12分)纳米TiO2在涂料、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
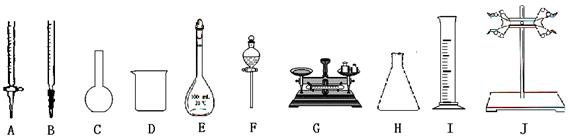
(1)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
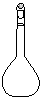
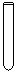
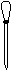
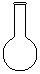
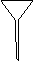
a b c d e
(2)滴定终点的现象是___________________________________________________。
(3)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
(4)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使配制结果______________。
②若在配制标准溶液过程中,俯视液面,使测定结果_________。
请回答下列问题:
(1)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
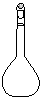
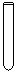
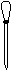
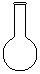

a b c d e
(2)滴定终点的现象是___________________________________________________。
(3)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
(4)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使配制结果______________。
②若在配制标准溶液过程中,俯视液面,使测定结果_________。
(1)抑制NH4Fe(SO4)2水解 ,a c (2)溶液变为红色
(3)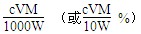 (4)①偏低 ②偏高
(4)①偏低 ②偏高
(3)
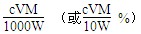 (4)①偏低 ②偏高
(4)①偏低 ②偏高(1)由于NH4+和Fe2+都水解,溶液显酸性,所以加入硫酸的目的是抑制NH4Fe(SO4)2水解;根据配制原理可知,还需要容量瓶和胶头滴管,答案选ac。
(2)因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3。
(3)根据得失电子守恒,有:1Ti3+~1Fe3+,故n(Fe3+)= n(Ti3+)= n(TiO2)=cV×10-3mol,其质量分数为
 。
。
(4)根据c=n/V可知, NH4Fe(SO4)2溶液溅出,则溶质减少,物质的量浓度减小;若俯视读数,则容量瓶中溶液的体积减少,浓度偏大。
(2)因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3。
(3)根据得失电子守恒,有:1Ti3+~1Fe3+,故n(Fe3+)= n(Ti3+)= n(TiO2)=cV×10-3mol,其质量分数为
 。
。(4)根据c=n/V可知, NH4Fe(SO4)2溶液溅出,则溶质减少,物质的量浓度减小;若俯视读数,则容量瓶中溶液的体积减少,浓度偏大。

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
 2KNO2+O2↑,
2KNO2+O2↑,