题目内容
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)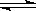 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡
移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K 1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4mol·L-1、4mol·L-1,则此时上述反应的平衡移动方向为 (选填“正反应方向”、“逆反应方向”、“不移动”)。
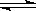 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填“吸热”、“放热”)。
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡
移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K 1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4mol·L-1、4mol·L-1,则此时上述反应的平衡移动方向为 (选填“正反应方向”、“逆反应方向”、“不移动”)。
(1)K=c(CO)×c(H2O)/c(CO2)×c(H2)
(2)吸热(3)不(4)等于(5)逆反应方向
(2)吸热(3)不(4)等于(5)逆反应方向
试题分析:(1)反应:CO2(g)+H2(g)
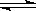 CO(g)+H2O(g)的化学平衡常数表达式为K=c(CO)×c(H2O)/c(CO2)×c(H2);(2)由表可以看出,温度越大,平衡常数K越大,所以该反应为吸热反应;(3)在其他条件不变的情况下,扩大容器的体积,相当于减小了压强,但是对于该反应减小压强并不会使平衡移动;(4)由表可以看出,在830℃时,K为1.0,所以向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K仍然为1.0,因为温度不变,平衡常数不变;(5)若1200℃时,平衡常数K为2.6,因为CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4mol·L-1、4mol·L-1,其离子积为4×4/(2×2)=4>2.6,所以此时上述反应的平衡移动方向为向逆反应方向进行。
CO(g)+H2O(g)的化学平衡常数表达式为K=c(CO)×c(H2O)/c(CO2)×c(H2);(2)由表可以看出,温度越大,平衡常数K越大,所以该反应为吸热反应;(3)在其他条件不变的情况下,扩大容器的体积,相当于减小了压强,但是对于该反应减小压强并不会使平衡移动;(4)由表可以看出,在830℃时,K为1.0,所以向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K仍然为1.0,因为温度不变,平衡常数不变;(5)若1200℃时,平衡常数K为2.6,因为CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4mol·L-1、4mol·L-1,其离子积为4×4/(2×2)=4>2.6,所以此时上述反应的平衡移动方向为向逆反应方向进行。点评:本题考查了化学平衡的相关知识,该考点是高考考查的重点和难点,本题要掌握对于一个确定的反应,温度不变,平衡常数不变。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Cr2O72-
Cr2O72-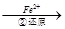 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓  Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O xC(g),在密闭容器中进行,下图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是( )
xC(g),在密闭容器中进行,下图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是( )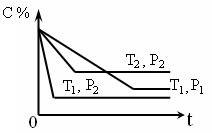
 C(g)+D(g),5 min后达到平衡。已知各物质的平衡浓度关系为
C(g)+D(g),5 min后达到平衡。已知各物质的平衡浓度关系为 2B(g)+C(g)。该反应达到平衡的标志是
2B(g)+C(g)。该反应达到平衡的标志是 2Z(g);
2Z(g); H<0,达到平衡时,下列说法正确的是
H<0,达到平衡时,下列说法正确的是 C(g) + D(g)(正反应为放热反应)已达到平衡状态的是
C(g) + D(g)(正反应为放热反应)已达到平衡状态的是  H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是 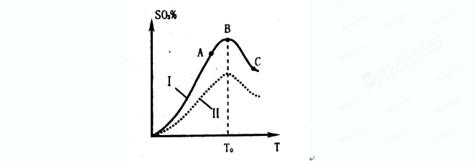
 2 SO3 达到平衡的标志是
2 SO3 达到平衡的标志是