题目内容
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 在常温、常压下,11.2LN2含有的分子数为0.5NA | |
| B. | 标准状况下,18gH2O的体积是22.4L | |
| C. | NA个SO2的体积是22.4L | |
| D. | 标准状况下,22.4LH2与O2的混合气体所含分子数为NA |
分析 A.常温常压下,不能使用标准状况下的气体摩尔体积计算;
B.标准状况下,水的状态不是气体;
C.没有告诉在标准状况下,不能使用标准状况下的气体摩尔体积计算;
D.标准状况下,22.4L气体的物质的量为1mol.
解答 解:A.不是标准状况下,不能使用标准状况下的气体摩尔体积计算11.2L氮气的物质的量,故A错误;
B.标准状况下,水不是气体,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.NA个SO2的物质的量为1mol,由于没有告诉在标准状况下,不能使用标准状况下的气体摩尔体积计算1mol二氧化硫的体积,故C错误;
D.标准状况下,1mol混合气体的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,所含分子数为NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,明确标准状况下气体摩尔体积的使用条件为解答关键,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
20.有关如图及实验的描述正确的是( )
| A. |  用图装置蒸发FeCl3溶液制备无水FeCl3 用图装置蒸发FeCl3溶液制备无水FeCl3 | |
| B. |  用图装置电解精炼铝 用图装置电解精炼铝 | |
| C. | 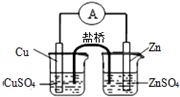 用图装置构成铜锌原电池 用图装置构成铜锌原电池 | |
| D. |  用图装置定量测定化学反应速率 用图装置定量测定化学反应速率 |
1.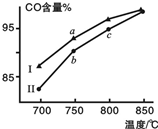 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:
CH4(g)+H2O(g)=CO(g)+3H2(g)
其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)=CO(g)+3H2(g)
其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
| A. | 相同条件下,催化剂Ⅱ催化效率更高 | |
| B. | b点表示上述反应在对应条件下的平衡状态 | |
| C. | 根据图象,无法判断该反应是否为吸热反应 | |
| D. | 该反应平衡常数表达式为K=$\frac{c(CO)•c3(H2)}{c(CH4)}$ |
9.下列说法正确的是( )
| A. | 章鱼胺的结构为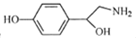 ,其分子式为C8H12NO2 ,其分子式为C8H12NO2 | |
| B. | 鸡蛋白可溶于水,加浓硫酸钠溶液和福尔马林均可使鸡蛋白溶液聚沉,但原理不同 | |
| C. | 葡萄糖、蔗糖、淀粉都属于糖类,三者互为同系物 | |
| D. | 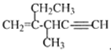 与足量H2反应的产物为3-甲基-2-乙基戊烷 与足量H2反应的产物为3-甲基-2-乙基戊烷 |
10.下列有机物系统命名正确的是( )
| A. | 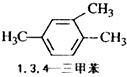 | B. | 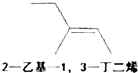 | C. | 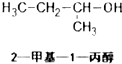 | D. |  |
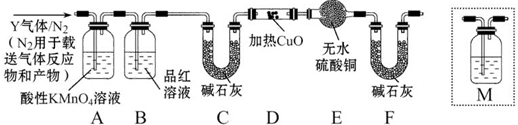
 A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去).
A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去).