题目内容
有三种说法:
①NH4NO3中氮元素显+5价;
②4FeS2+11O2-→2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等.
这三种说法中错误的是
- A.只有①
- B.只有②③
- C.只有①③
- D.①②③
D
分析:从化合物中各元素的化合价判断①②,氧化还原反应中还原剂失电子,氧化剂得电子,以此判断③.
解答:①中N元素有-3价和+5价两种价态,故①错误;
②中S元素的化合价为-1价,故②错误;
③氧化还原反应中还原剂失电子,氧化剂得电子,故③错误.
故选D.
点评:本题考查氧化还原反应,题目难度不大,注意从正确判断元素的化合价为解答该题的关键.
分析:从化合物中各元素的化合价判断①②,氧化还原反应中还原剂失电子,氧化剂得电子,以此判断③.
解答:①中N元素有-3价和+5价两种价态,故①错误;
②中S元素的化合价为-1价,故②错误;
③氧化还原反应中还原剂失电子,氧化剂得电子,故③错误.
故选D.
点评:本题考查氧化还原反应,题目难度不大,注意从正确判断元素的化合价为解答该题的关键.

练习册系列答案
相关题目
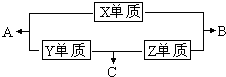 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化: